
|
英国 MHRA 2019 年 GMP 检查缺陷趋势分析
2020.10.20
英国药品与医疗保健产品监管机构(MHRA)于 2020 年 10 月 15 日发布了其 2019 年的 GMP 检查缺陷。与去年一样,2019 年 GMP 检查缺陷数据同样采用了电子表格的形式,共5293 行数据。有兴趣者可以根据需要自行解析和呈现数据。【英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览...
|

|
礼来计划生产新冠治疗性抗体的工厂爆出删除数据和造假...
2020.10.15
美国 FDA 检查员在礼来公司的制药工厂发现了严重的质量控制问题,该工厂正在准备生产一种颇具希望的新冠抗体治疗药物。
礼来的实验性药物称为 LY-CoV555,是一种单克隆抗体,与特朗普患病期间使用的 Regeneron(再生元)的药物类似,其作用是识别并锁定外来入侵者,从而阻止健康细...
|

|
FDA 远程索要超五百份记录,将更新远程监管评价流程
2020.09.19
美国 FDA 监管事务办公室(ORA)在疫情期间已经在未现场检查的情况下对数百家药品生产场地的质量做出判断,FDA 助理局长 Elizabeth Miller 在 9 月 16 日 PDA/FDA 联合监管会议上的报告如是表示。
她指出,这为制药企业提供了一定程度的保证,即,在病毒广泛传播时,许多...
|

|
法律专家对 FDA 疫情期间检查指南的解读与预测
2020.09.01
法律专家认为美国 FDA 新发布的疫情期间药品检查问答指南为行业留下了一些余地,可以提出新的方法来评估 GMP 合规符合性而无需进行现场检查。法律专家认为,可灵活发挥的程度将取决于 FDA 如何执行该指南,以及是否会发布更多指南。
FDA 于 8 月 19 日发布《COVID-19 公共...
|

|
欧盟无菌附录修订草案中 PUPSIT 要求仍遭到业界反对
2020.08.31
欧盟无菌 GMP 附录(Annex 1)第二轮征求意见期已于 7 月 20 日结束,此次意见征求可能是对于欧盟无菌附录重大修订最终敲定之前的最后反对机会,业界再次对于要求过滤器测试策略的提议表示担忧,认为该策略可能导致其本想防止的严重污染。
虽然非肠道药协会(PDA)承认,总体而言...
|

|
【周末杂谈】触家规就是犯国法吗?
2020.08.16
了解美国是如何将药品法与GMP规章和企业内部操作绑在一起的
没按SOP做,就是违法吗?
SOP是企业的家规,与《药品法》有何关系?
与罚款更多的《虚假宣称法》又有何关系?
简单的答案是,关系直接且密切。
先来看看美国历史上两件最大的因GMP违规,而受到法庭处罚的案例。
第一个...
|

|
FDA 宣布恢复国内检查,那么国外检查呢?
2020.07.16
7 月 10 日,美国 FDA 宣布了其准备从 7 月 20 日的那一周开始重启国内现场检查的目标。接受检查的美国区域应是在 FDA 的评级系统中显示 COVID-19 情况最为安全可以执行优先检查的区域。FDA 的评级系统基于州和国家数据评估了当地的 COVID-19 病例数。
评价级别基于...
|

|
亚硝胺杂质带来的深远影响:GMP 要求扩大和前移
2020.07.06
前不久我们介绍了欧盟发布的关于亚硝胺杂质事件的经验教训报告,报告从多个方面给出了建议。【欧盟报告全面总结沙坦类药物中亚硝胺杂质的经验教训 2020/06/25】报告给出的建议都非常实际,其中关于 GMP 及相关指南修订方面的建议影响更为深远。今天我们就重点来看一看,亚硝胺杂质事...
|

|
因为疫情警告信不能关闭怎么办?
2020.07.03
那些先前在美国 FDA 的检查中发现了严重质量问题的制药商,即使已经做了相应的整改纠正措施,可能也不得不等到新冠(COVID-19)疫情消退之后,FDA 重启后续场地检查,才可能会恢复与场地相关的申请的审评工作。
自 3 月中旬 FDA 宣布除最紧迫的“关键任务”检查外,推迟所有现场检...
|

|
FDA 何时能恢复检查,是否有权远程索要工厂文件记录...
2020.06.26
自美国 FDA 宣布因新冠大流行而暂停或推迟大多数国内外场地检查已经过去了三个多月【WHO 宣布全球大流行,FDA 暂停境外检查和外部会议 2020/03/12】。从那之后,FDA 显然只进行了“关键任务”的监督检查,大部分已注册设施都留在了 FDA 的检查清单上,等待 FDA 恢复检查行动。...
|

|
药厂生产员工感染新冠怎么办?FDA 正式给出 GMP 考...
2020.06.22
指南针对不同类型的产品给出了相应法规指南依据并给出具体建议
美国 FDA 于 6 月 19 日发布了题为《在药品和生物制品生产中应对员工 COVID-19 感染的 CGMP 考量》的指南,就 CGMP 要求和期望向制药企业(包括外包设施)提供建议,以防止药物污染并禁止患病员工直接从事药...
|

|
【周末杂谈】疫情过后,特事特办的做法也应随即退出?
2020.06.21
养成好的GMP习惯不容易,靠日积月累。但稍不注意,就容易懒散下来。
在Covid-19疫情紧张情况下,社会急需相关医药产品。此时,医药产品上市评估所依赖的风险和获益比的计算发生了突变。由于没有特效药,用药副作用的风险与不用药患者就可能面临严重肺损伤甚至死亡的风险相比,就显得没...
|

|
FDA 对顺势治疗产品再开刀,更强力监管就在前方不远...
2020.06.18
6 月 16 日,FDA 宣布向四家将未批准注射药品标记为顺势治疗产品的公司发出警告信,标志这 FDA 可能准备着手对付顺势治疗市场的监管问题。
我们曾介绍过 FDA 在过去几年对顺势治疗产品的监管立场相关的信息,早在 2015 年 FDA 就在考虑对药物实施药品监管的必要性,并召开...
|
|
FDA 因无菌保证缺陷和可见微粒调查不充分警告武田制...
2020.06.18
美国 FDA 于 6 月 16 日公布了一封发给日本武田制药(Takeda Pharmaceutical)的警告信,主要问题就是无菌缺陷。
无菌保证一直是 FDA 检查的关注点,使用无菌工艺生产的产品也一直被视为是高风险产品。【FDA 总结 2019 财年警告信四大趋势 2019/09/24】而从对英国 GMP...
|

|
细胞与基因治疗产品常见 GMP 缺陷及质量管理挑战
2020.06.12
美国 FDA 检查员表示在对细胞和基因治疗产品的检查中更常发现设施和生产缺陷,而行业则表示,药品 GMP 并不总是适用于细胞和基因产品。
6 月 1 日举行的 ISPE 生物药制造网络研讨会上,FDA 官员在研究中指出,在 483 表报告的 GMP 缺陷中,比起其它类型的产品,细胞和基...
|

|
英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览
2020.05.26
英国药品与医疗保健产品监管机构(MHRA)于 2019 年 10 月发布了其在 2018 年的 GMP 检查缺陷,与前几年不同,2018 年 GMP 检查缺陷数据采用了电子表格的形式,公布了 6200 多行数据,人们可以根据自己的需要进行解析和呈现数据。而此前的 2015 年,MHRA 均是提供的约 10...
|

|
欧盟和英国在疫情期间放宽部分 GMP 要求
2020.04.27
鉴于新冠疫情(COVID-19)大流行带来的挑战,欧盟和英国药品监管机构(MHRA)均不同程度放宽了对 GMP 的解释,以保障疫情期间的药品供应。https//www.gov.uk/guidance/exceptional--flexibilities-for-medicines-manufacturers-during-the-coronavirus-covid-19-outbreak M...
|

|
欧盟无菌GMP指南第二轮征求意见稿发布
2020.02.22
2020年2月20日,欧盟发布了无菌GMP附录(Annex 1)的第二轮征求意见稿,这是2017年12月20日发布的征求意见稿时隔两年多的再次更新。WHO和PIC/S也同步征求意见,最终实施后会对全球无菌制剂企业产生重大影响。
不是修订,而是重写
欧盟无菌附录 1971年首次颁布,期间经过多次修订...
|

|
来自欧盟的专业贺礼 – MAH和GMP法规体系官方梳理
2020.01.23
前天,EMA公布了GMP和MAH思考性文件的征求意见稿(Reflection paper on good manufacturing practice and marketing authorisation holders)。该指南系统的梳理了欧盟MAH的法规体系,及其和相应GMP文件的对应关系,识林正在翻译这份指南,并建设该专栏。
MAH相关法规指南数量...
|
|
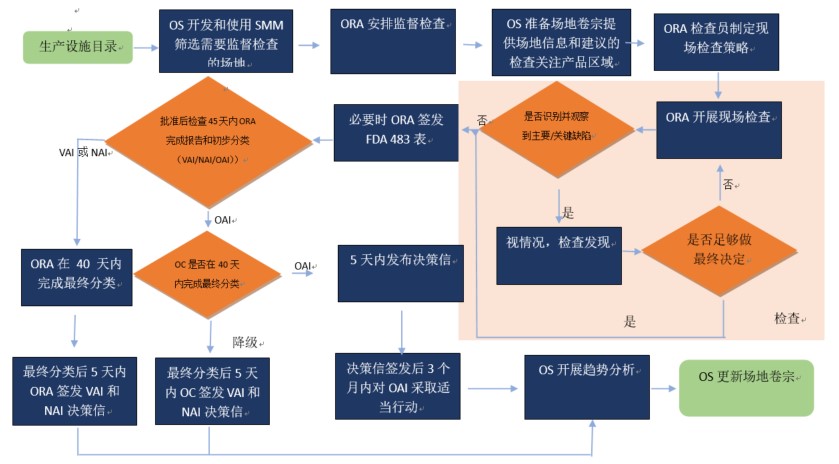
GMP 检查结束到最终合规判定的 90 天发生了什么?
2020.01.22
遇到过几家企业,检查结束后感觉不错,也没感觉FDA检查员说什么严重的,但最后结果是OAI(Official Action Indicated, 官方行动指示,即检查不通过),甚至还吃了警告信,那么检查之后FDA内部是怎样的流程呢?
FDA 90天合规判定的绩效逐步实现
根据GDUFA II,FDA承诺在检查结束...
|