
|
加速批准艰难撤销:12 年后企业终“自愿”撤销有争议...
2023.03.09
经过 2 年多的缠斗,Covis 药业终于同意撤销其有争议的早产预防药 Makena,至此,这一加速批准药物的艰难撤销之旅似乎可以宣告落幕,但最终究竟以何方式收场还需等待 FDA 的最终裁定。
Makena(17 α-己酸羟孕酮,又称 17P)于 2011 年 2 月在加速审批路径下获批,FDA 当...
|

|
研究人员敦促 FDA 加强对加速批准药品标签的监管
2023.03.09
最近发表在《药物治疗》(Pharmacotherapy)上的一篇新的分析文章1表明,美国 FDA 加速批准的药物中超 10% 不符合 FDA 2019 年发布的关于加速审批药品标签的指南要求。研究人员指出,缺乏标签透明度会影响处方习惯,呼吁 FDA 通过与制药商开会、发警告信和处以罚款来确保标签合规。
...
|

|
美国医保或试行新政为加速审批药物支付更少费用
2023.02.03
据报道,美国医疗保险和医疗补助服务中心(CMS)可能会试行一项政策,为获得加速批准的药物支付的费用低于获得传统批准的药物。
美国 FDA 利用加速审批根据预测临床结果的替代终点作为依据批准药物,使患者能够更快地获得治疗严重疾病的有前景的药物。但并非所有药物都能奏效。根据 Am...
|

|
加速审批改革:FDA 似不会严格执行加速批准之前完成...
2023.02.01
美国 FDA 药品审评与研究中心(CDER)首席副主任日前在一次会议上介绍了 FDA 计划如何行使新法案赋予的对加速审批路径监督的额外权力。
美国国会于去年年底通过的政府综合拨款法案授权 FDA 加强对加速审批药物的监管,FDA 将有权制定了加速审批药物确证性试验的设计,并可能会要...
|

|
美国综合拨款法案将加强 FDA 对药品加速审批路径的...
2022.12.21
根据 12 月 20 日公布的美国政府综合拨款法案文本 药物的监管,FDA 将有权指定加速审批药物确证性试验的设计,并可要求制药商每 180 天报告一次确证性试验的完成进度。
根据法案,FDA 还可能会要求寻求快速审批路径的制药商在获得 FDA 许可之前就启动确证性试验,FDA 似在...
|

|
加速批准有望加速撤销?GSK在确证性试验失败后迅速撤...
2022.11.23
葛兰素史克(GSK)于 11 月 22 日宣布,应美国 FDA 要求,GSK 正在从美国市场撤出 Blenrep。在此之前,GSK 刚刚于 11 月初宣布 Blenrep 在治疗此前至少接受过两线治疗的复发或难治性多发性骨髓瘤方面,效果不及百时美施贵宝(BMS)的 Pomalyst 和地塞米松联合治疗方法。
...
|

|
FDA 似正收紧加速审批要求:申报时需完成确证性试验...
2022.11.23
美国 FDA 似乎已经默默地开始对加速审批项目进行改革。
ADC Therapeutics 公司于 11 月 8 日在其第三季度收益报告上表示,“在 FDA 提供了强有力的指导,使其重新考虑加速审批路径之后,公司正回过去重新评估其实验性靶向 CD25 的新型抗体偶联药物(ADC)Cami(camidanlumab tesi...
|

|
研究显示 FDA 加速审批计划整体达到预期目标
2022.09.02
1992年,为了应对艾滋病的流行,FDA制定了加速审批(accelerated approval)政策。2012年,加速批准途径被美国国会纳入法规,用于“加速”治疗危重疾病的药物进入临床。
在快速批准中,药物是否通过审批通常是以替代终点作为依据,FDA将其描述为“一种标记物,例如实验室测量值、放射...
|

|
研究表明制药商没有动力完成加速审批的确证性试验
2022.09.02
根据最新发表在 Health Affairs 上的一项分析研究1显示,通过美国 FDA 加速审批路径批准的抗癌药物在经过确证性试验证明有临床获益后并未获得价格上涨。
研究作者包括布鲁金斯学会的 Richard Frank,哈佛大学的 Mahnum Shahzad,以及宾夕法尼亚大学的 Ezekiel Emanuel。研究...
|

|
激烈争论中,使用者付费法案(UFA)重新授权即将在参...
2022.06.23
在得到众议院能源和商业委员会批准后,众议院6月8日以392票对28票通过了使用者付费的重新授权,而参议院也在加快最后批准。从目前来看,两方版本都提出了不少改革措施,包括了仿制药领域、加速审评审批途径、临床多样性等非常多的方面。继之前的资讯提及的焦点议题,两院法案即将相继通过...
|

|
JAMA研究揭示FDA批药比EMA快得多,然而数量与质量孰重...
2022.06.16
FDA和EMA是全球最具代表性的两个药品监管机构,在全球药品监管中扮演着相当重要的角色。尽管批准程序存在差异,但在所有治疗领域的90%以上的新疗法注册中,FDA和EMA的批准都保持着密切的一致性。确保患者及时获得安全有效的药物是监管的一个重要目标,尤其在供不应求的肿瘤领域。当某一新...
|

|
美国立法机构终于要对 FDA 加速审批计划开刀了?
2022.03.09
美国众议院能源和商业委员会主席民主党人 Frank Pallone 于 2022 年 3 月 7 日提出《加速审批可靠性法案》(Accelerated Approval Integrity Act),该法案将提升美国 FDA 的权力,确保获得加速批准的药物能够提供经过证明的临床获益。
Pallone 表示,“加速审批计划在制药...
|

|
FDA 将继续召开专家会审查是否应保留两个加速批准肿...
2021.09.28
美国 FDA 之前在对肿瘤学加速批准药物的全行业审查中以癌症免疫疗法为目标,这些药物未能通过确证性试验证实其获益【从三天 PD-1 L1 专家会看加速审批未来和专家与监管者态度 2021/05/04】。但 FDA 并没有就此止步。
FDA 于 9 月 24 日表示,将于 12 月 2 日召开一...
|
|
默沙东 K 药在肝细胞癌方面的确证性试验显露曙光
2021.09.28
默沙东的 Keytruda(帕博利珠单抗)针对曾用索拉非尼治疗的肝细胞癌的适应症在经历了对两项生存指标的不明确的确证性试验后,加速批准状态看来摇摇欲坠。但肿瘤药专家咨询委员会(ODAC)在 4 月份仍投票建议将该药保留在市场上。现在 K 药在肝癌适应症方面的另一项试验带来了一些好消...
|

|
三分之一加速批准的癌症适应症在确证性试验失败后仍保...
2021.09.15
英国医学杂志(BMJ)上发表的一项分析发现,即使在后续研究未能证实获益之后,三分之一获得加速批准的抗癌药的产品标签上仍保留有这些适应症。同时,被广泛阅读的医生指南也在继续推荐这些治疗方法。
这一研究是针对近三十年前创建的加速审批计划,该计划是为了加快医疗需求未得到满足...
|

|
专家提出改革 FDA 加速审批路径的 10 项措施
2021.08.26
美国 FDA 加速审批计划已经实施超过 25 年,随着各方的质疑,这一路径似乎已经到了面临选择的十字路口。
大约一年前,FDA 肿瘤卓越中心启动了对抗癌药加速审批的审查。【FDA 正广泛审查加速审批程序,已撤销四个癌症适应症 2021/03/12】;【从三天 PD-1 L1 专家会看加速审...
|
|
加速批准艰难撤销:FDA 将举行听证审查有争议的早产...
2021.08.24
根据 8 月 19 日 Covis 公司的新闻稿,美国 FDA 将举行听证会,讨论 Covis 是否应在一项关键研究发现药物无效后自愿撤销其早产预防药 Makena(17 α-己酸羟孕酮,又称 17P)。
两年前,FDA 专家顾问委员会建议在确证性试验未能证实临床获益后撤回 Makena。97 的投票结...
|
|
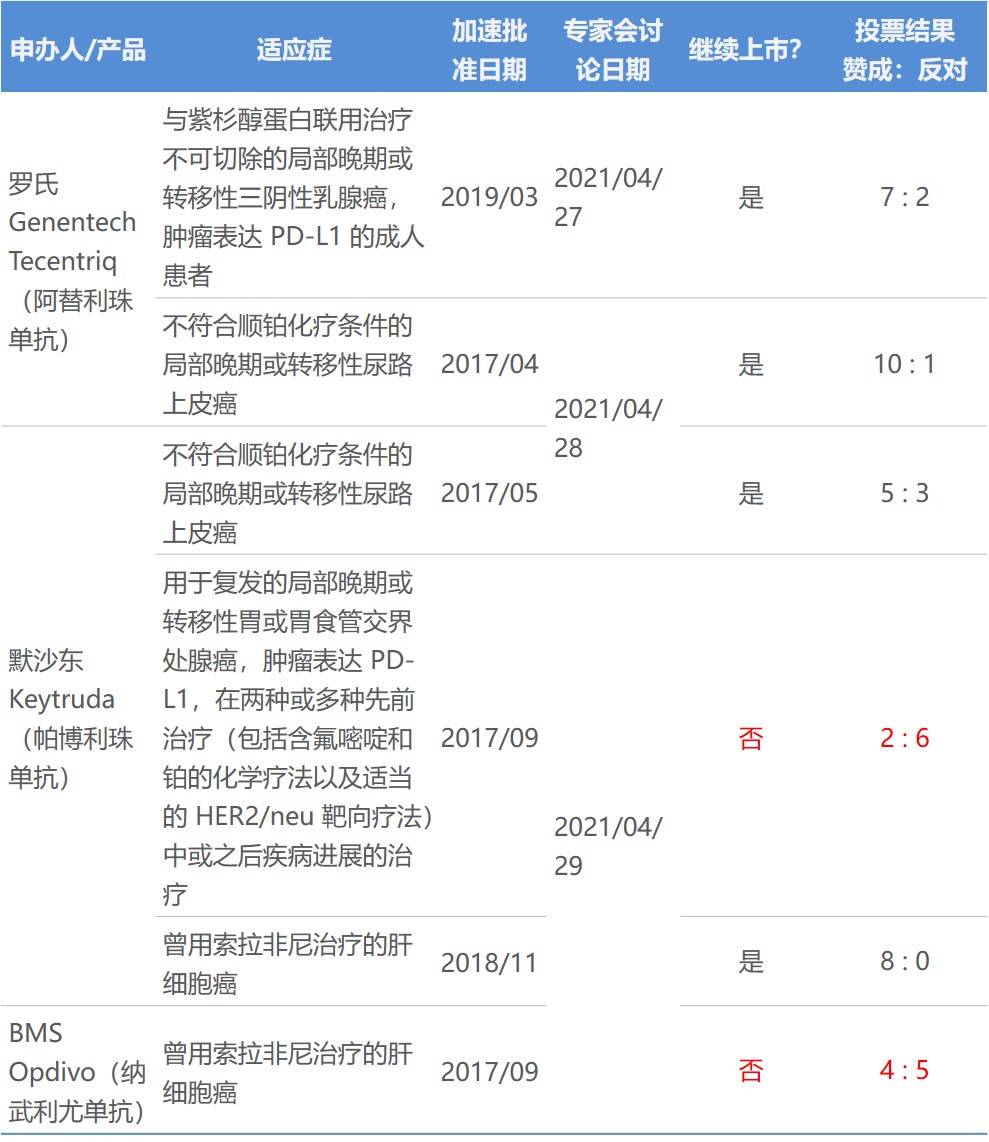
从三天 PD-1 L1 专家会看加速审批未来和专家与监...
2021.05.04
美国 FDA 对三个 PD-1/L1 药物的六个加速审批适应症持续三天的专家会审已经结束,尽管肿瘤药咨询委员会(ODAC)的投票表明某些检查点抑制剂的适应症可能很快会从产品标签中删除,但加速审批监管途径本身的地位并未受到威胁。
PD-1/L1 抑制剂的申办人在 4 月 27 日至 29 ...
|

|
PD-1 L1专家审查第二天:K药和T药膀胱癌适应症前景...
2021.04.30
美国 FDA 肿瘤药专家咨询委员会(ODAC)两个不同的专家小组于 4 月 28 日讨论了默沙东Keytruda(帕博利珠单抗,K药)和Genentech 的 Tecentriq(阿替利珠单抗,T药)各自关于膀胱癌适应症的加速批准。两个药尽管免疫疗法和适应症相似,但专家投票数却大不相同。
专家投票结果:...
|

|
罗氏阿替利珠单抗获 FDA 专家会支持保留加速批准适...
2021.04.29
美国 FDA 于 4 月 27 日组织召开的肿瘤药专家咨询委员会(ODAC)建议 FDA 保留罗氏 Genentech 的 PD-L1 抑制剂 Tecentriq(阿替利珠单抗)的三阴性乳腺癌加速批准适应症,等待进一步试验确证其临床获益。
尽管一些专家组成员认为,需要一项新的确证性试验来模仿 IMpassion1...
|