
|
FDA 发布咀嚼片的质量属性考量定稿指南
2018.08.22
美国 FDA 于 8 月 20 日发布《咀嚼片的质量属性考量》定稿指南。该指南向新药申请(NDA)、仿制药申请(ANDA)、一些化学补充剂、IND 的申办人以及非申请的咀嚼产品生产商提供有关可咀嚼速释片剂鉴定和量化应有的关键属性的建议。
该定稿指南的草案版本于 2016 年 6 月 16...
|

|
识林线下交流会 201808
2018.08.22
识林线下交流会
大家好,由于识林APP上线等工作,线下线上的交流有所延误,随着识林团队的不断发展壮大,近期将恢复积极参与者的线下交流活动。
活动会邀请业内同仁与大家面对面交流,也欢迎大家推荐专家或毛遂自荐,同时欢迎大家提出感兴趣的话题。
本次活动请到MHRA、欧盟和...
|
|
FDA 高溶解性原料药速释口服固体药溶出度和接受标准...
2018.08.21
在 IND、NDA、ANDA 申请中,有关含高溶解性原料药的口服速释(Immediate Release, IR)产品可以使用标准释放试验和标准去替代大量的方法开发和可接受标准制定工作,这些标准的可用性将有助于快速开发溶出方法和相关接受标准,而不要求在药品研发阶段证明这些溶出方法对产品的分辨能力...
|

|
IPEM 十周年专题报告会
2018.08.21
Regulate sensibly 合理监管,develop scientifically 科学研发,manufacture competitively 高效生产,compete respectfully 尊矩竞争,and manage responsibly 尽责管理 — 摘自IPEM招生简介
IPEM所学与所用 — IPEM十周年专题报告会
2018年8月31日(周五)
...
|

|
信誉比专业更重要,前西门子人士出任诺华首席道德官
2018.08.20
Klaus Moosmayer 出任诺华首席道德、风险与合规官,以重塑丑闻后的公司信誉。
Moosmayer 将于今年 12 月 1 日加入诺华,直接向首席执行官汇报。诺华在其任命公告中将 Moosmayer 称为“道德与合规领域公认的全球领导者”。他的简历包括在经济合作与发展组织担任工商业咨询委员...
|

|
【更新提示】药政信息摘要2018.08
2018.08.19
【CDE】关于《预防用疫苗铝佐剂技术指导原则》征求意见的通(08.18)
【CNDA】关于12批次药品不符合规定的通告(2018年第73号)(08.18)
【EMA】抗癫痫药物临床研究指南草案(08.18)
【CFDI】药物临床试验数据现场核查计划公告(第21号)(08.17)
【EMA】质量...
|
|
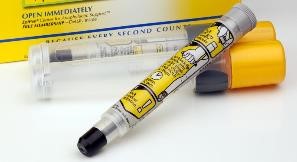
复杂仿制药研发的胜利 — 首个 EpiPen 仿制药获批
2018.08.18
【编者按】对药械组合产品的仿制药,疗效等效意味着不仅要药物等效,在装置使用方便性上,也要同样好使。但达到使用装置上的等效不易。FDA 在去年的药械组合仿制产品指南中曾严格这方面的要求,今年 4 月份 FDA 表示可能会重新考虑这一要求,允许某些装置差异。EpiPen 仿制品的获...
|

|
国际危机事件管理的法律、商务和技术考虑
2018.08.17
“尚质学社”学习交流会 — 国际危机事件管理的法律、商务和技术考虑
2018年9月2日 (周日) 900-1330
数据可靠性(DI)引起的进口禁令和警告信危机还未趋缓,原料药杂质引起的全球产品召回危机又至。快速升级的中美贸易战更是雪上加霜。了解美欧市场的监管风险、商务风险、...
|

|
公众对生似药与复杂仿制药的接受程度不尽如人意?
2018.08.16
许多文章都曾谴责这样一个事实,即,对生物类似药的使用程度远低于美国 FDA 或业界预期。我已经在这个行业以不同身份工作了 46 年(药剂师、监管者和顾问),见惯了这样的情况。有人说历史再次重演,但今天的观念和力量与 Hatch-Waxman 法案首次颁布时的是一样的。什么观念和力量?...
|

|
贸易战下的合规风险 — 美国新法案可能影响我国制药...
2018.08.15
【编者按】随着贸易战的不断升级,专业人士开始认识到贸易战绝不是加税减税这么简单,高科技产品和技术不仅面临准入风险,合规帐全面清算,将产生更为深远的影响,在中国企业近期的召回事件中,FDA 高层领导的频繁表态,表明技术因素不是FDA的唯一考虑,君合是国内权威律所,他们近期在...
|

|
2018 年 FDA 首仿药清单小结
2018.08.14
【编者按】多年来,首仿药意味着价格比品牌药略低但远高于一般仿制药,意味着抢占市场……现如今对于越来越多的复杂产品来说,首仿更意味着一种鼓励、一种证明,当前技术可以成功地开发出与复杂产品等效的仿制药。FDA多批快批首仿药,并提高透明度,有助于企业,更有益于民众。
“首仿...
|

|
识林原料药注册指导三大工具:第二部分“初始递交材料...
2018.08.13
法规环境日益严格和复杂,注册的责任和压力也越来越大,既要对内准确传递监管的要求,又要对外严格满足监管的要求,例如:
- 官方缺陷信回复的时限日益紧迫,企业面临缺陷大海捞针查指南,耗费宝贵时间;
- 不同监管机构、不同指南之间内容重复但不重合,容易顾此失彼;
...
|

|
WHO 生物类似药问答指南草案中文翻译
2018.08.12
两周前,WHO 发布《生物类似药问答指南草案》,识林对指南内容做了简要介绍【WHO 就八年来生物类似药的常见问题给出指导 2018/07/31 】。识林现已将指南草案译成中文。
问答草案涉及概念、参照生物药、质量、非临床、临床和药物警戒六大块共 48 个问题。其中包括对于在什么情况...
|

|
缬沙坦风波再起,FDA 公布两份华海检查 483
2018.08.11
美国 FDA 于周四公布了两份分别于2016 年 11 月和 2017 年 5 月签发给浙江华海药业的 483。虽然 483 观察项中涉及到的具体产品名称均被涂黑,但华海是缬沙坦原料药的主要供应商之一。FDA 此时公布这两份 483 意味深长,有可能是 FDA 在审查相关问题后主动公布,更有可能...
|

|
FDA 首个获得竞争性仿制药认定的产品获批
2018.08.09
美国 FDA 于 8 月 8 日批准了几种规格的氯化钾口服液,成为通过竞争性仿制药(CGT)认定批准的首例仿制药。这一新批准路径旨在加快针对缺乏竞争产品的仿制药的研发和审评。氯化钾是一种口服治疗药物,适用于治疗和预防使用利尿剂患者在缺少富钾饮食或无法减少利尿剂用量时的低钾血症...
|

|
FDA 元素杂质定稿指南发布
2018.08.08
美国 FDA 于 8 月 7 日发布《成品药中的元素杂质》定稿指南【中译】,解释了何时对成品药中的元素杂质开展风险评估。该指南定稿了 2016 年 6 月 30 日发布的草案文件。2018 年 1 月 1 日,ICH Q3D 元素杂质指南与美国药典通则和 同时生效,控制成品药中的元素杂质。定稿指南...
|

|
业界探讨如何使 ICH Q12 的价值最大化
2018.08.07
行业正在探索 ICH Q12 生命周期管理概念如何在内部实施中以及在与监管机构的互动中最大化实践价值。ICH 专家工作组(EWG)成员鼓励业界与工作组分享其经验、实施挑战以及如何改进指南草案。工作组还有兴趣听取行业对于证明有效的实施策略的反馈,从而可以作为培训工作的一部分更广泛地...
|

|
美国药品代码格式迎来新变化
2018.08.06
美国国家药品代码(NDC)是处方药产品的唯一标识符。FDA 在联邦公报发布https//www.federalregister.gov/documents/2018/08/07/2018-16807/hearings-future-format-of-the-national-drug-code 通告表示未来几年内将改变 NDC 格式以适应更多厂商进入美国市场的需要。FDA...
|

|
EMA 和 FDA 将联手解决加快审批产品的质量问题
2018.08.05
欧洲药品管理局(EMA)和美国 FDA 计划于今年 11 月份召开研讨会,讨论监管机构的早期评估项目 — EMA 的 PRIME(优先药品)计划和 FDA 的突破性治疗认定(BTD)计划下药品研发所面临的质量和生产相关问题。
研讨会将于 11 月 26 日在 EMA 伦敦总部召开,届时欧盟监管机构...
|

|
FDA 向三个连续制造项目提供近六百万美元资金
2018.08.03
根据美国 FDA 8 月 1 日公布的消息,FDA 根据《21 世纪医药法案》向高等教育机构和非营利组织提供了三项资金支持,以研究和建议改进药品和生物制品连续制造的改进,以及类似的创新监测和控制技术。获得资金支持的机构和项目分别是:
• 罗格斯大学,工业 4.0 在连续药品制造中...
|