2024年全球主要监管机构药品法规指南概览
|
首页 > 资讯 > 2024年全球主要监管机构药品法规指南概览 出自识林
2024年全球主要监管机构药品法规指南概览
历史版本(Version List)展开 ∨收起 ∧
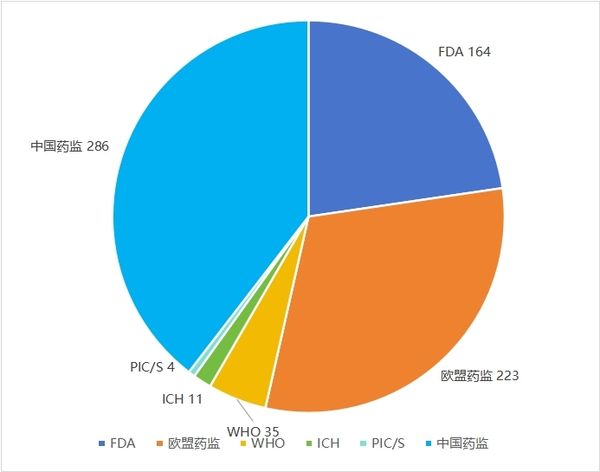
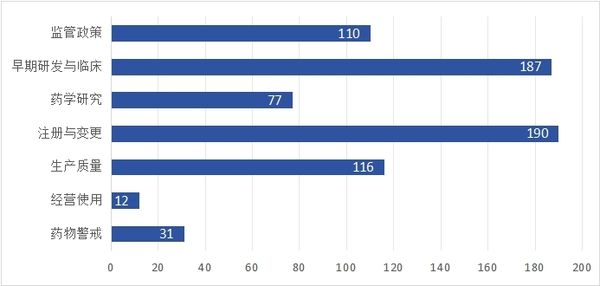
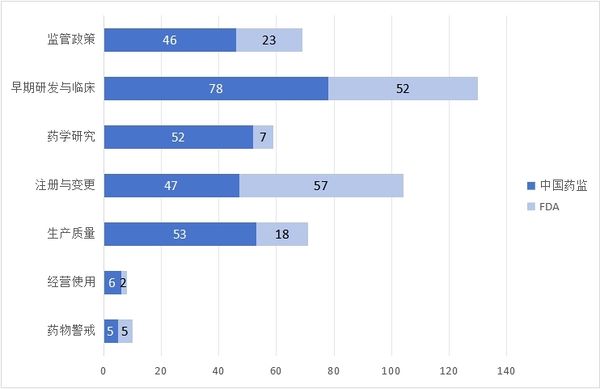
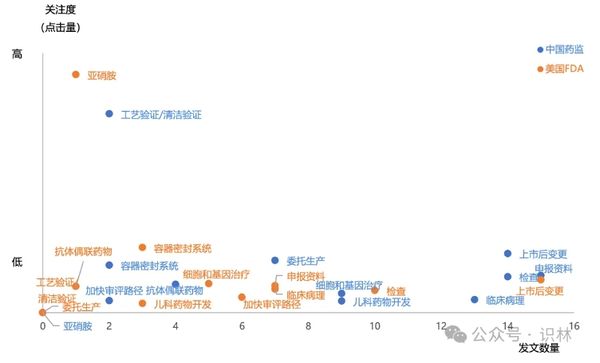
2025-01-03 2024年度全球法规指南报告可点击查看《识林法规指南导航:2024年全球药监》 2024年,识林更新了全球主要监管机构的数千份官方文件。剔除各类公告通知、个药标准或BE、年度报告等内容,仅保留与企业日常工作最相关的法规指南内容, 6大主要监管机构发布了723篇法规指南类文件。其中,中国286篇(包含非药监部门发布的重要文件),欧盟药监223篇,美国FDA 164篇,ICH 11篇,PIC/S 4篇,以及WHO 35篇。 本文将对上述文件做分类,并基于分类和发布时间,为大家做简单的导读。能力和篇幅所限,不求全面而精深,只为与业界同仁一起回顾刚刚过去的2024年药品监管领域的重点与亮点,展望今年的各项工作。无论业界如何风云变幻,药品生命周期全过程的合规将永远是承载着人民群众生命健康的制药业的根本所在。 *识林会员可关注识林即将发布的《2024年全球药监法规指南导航》中的详细目录。 *对于非会员读者,参与下周的“12月法规月报划重点”直播,也有机会获取《2024年全球药监法规指南导航》。 基于数字的概览 可以看到,中国药监体系保持着与2023年一样的势头,继续倾力构建坚实的药品监管法规体系,在发文数量上处于领先。FDA的数量相比2023年有所下降,而欧盟升至第二。WHO和ICH与2023年持平,PIC/S则在2023年大量更新GMP指南的基础上,仅更新了4篇指南文件。 国际组织虽然发布量较低,但影响面却可能相当广。PIC/S的4篇文件分别针对“加入程序和标准”和“远程评估”,前者是正走在申请路上的NMPA必须关注的,而后者可能引导全球药品检查逐步尝试更多的“远程检查”,从而充分利用日新月异的互联网技术,在确保检查效果的同时降低成本。这也是企业所乐见的。 与2023年主题分布于生命周期各阶段不同,ICH的11篇中大多数与临床试验有关,包括M12相互作用,M14真实世界数据,M15模型引导药物研发等等。WHO依然更加关注低收入地区的疾病和药物,但药用辅料GMP、亚硝胺和QC实验室规范等指南也引起了国内业界广泛关注。 从分类数量来看,一如既往,临床和注册领先,经营和药物警戒较少,药学研究与生产质量居中。 中国药监与FDA 将目光聚焦到中、美两个药监体系,先从发布数量看。 与各有侧重的国际组织不同,中美监管机构需要对所辖范围内大量公民的用药健康负责,因此发布的文件涵盖整个药品生命周期,但在细节上也能看出差异。这尤其反映在中国药监在大多数分类的发布数量上均领先FDA。对比2023年概览中的数据,我国曾经在“早期研发与临床”领域落后,如今也实现了数量上的反超。当然,数量不能等同于质量和影响力(此外由于监管体系差异,统计口径也存在差异),但这些数字在一定程度上体现出我国在药物研发创新的道路上的探索和进步,也将成为接下来监管与业界共同努力向前的基础。 再从关键词看。 这些关键词,是从识林用户点击量最高的2024年发布文件中提取的,体现的是监管发文与业界关注点的契合。从这个角度看,相比2023年的关键词(1 持有人和委托生产;2 检查;3 亚硝胺;4 加快审评;5 上市后变更;6 儿童药;7 污染;8 说明书;9 真实世界;10 先进疗法;11 沟通交流;12 放射性药品;13 药品短缺;14 以患者为中心),大同小异。 看一些处于极端位置的关键词。 从点击量上看,FDA的“亚硝胺”,仅发一文《人用药中亚硝胺杂质的控制》但点击量很高,而国内2024年并未针对其发文。查阅识林主题词【亚硝胺】可知,国内指南还是2020年的《化学药物中亚硝胺类杂质研究技术指导原则(试行)》。与之相对的是国内的“工艺验证/清洁验证”,CFDI在2024年发布的两篇指南,针对生产质量体系的两个棘手问题,且填补了国家级指南的空白。而FDA未发相关文件。 从发布数量上看,FDA发了相当多与“上市后变更”有关的文件,其中《MAPP 5018.3 ICH Q12 中所述既定条件的实施》尤其值得我国企业和监管关注,因为Q12即将在我国实施(根据NMPA适用公告 ,2025年8月25日时两年过渡期截止),但从业界反馈看,尚未发挥这个指南对于变更的促进作用。国内药监发了较多指导“申报资料”编写的文件,其中的境外地产化、生物制品分段申报等文件都旨在切实推进相关政策的实施。 基于分类,中外对比,回顾每月重点发布 下面按照监管政策、早期研发与临床、药学研究、注册与变更、生产质量和经营使用与药物警戒主题,将每个类别的重点文件概要回顾。 不同企业和岗位,对“重点”的理解自然不同。本文中是基于对文件影响力的理解以及识林用户的点击数据做综合判断,概述也不会涉及其中每一篇文件,仅供大家回顾参考。 药监年度重点发布概览:监管政策 监管政策领域的文件,大多看似与药企日常工作关系不大,但往往具有相当的前瞻性,可能对业界带来深远的影响。
药监年度重点发布概览:早期研发与临床 该分类主要包含与临床试验相关的文件,但也有非临床研究以及更早期的药物发现和成药性评估的内容。无论是数量、新技术含量、还是关注度,这个领域一直以来就是药监发文的重中之重。我国制药业自审评审批制度改革以来迈入药品创新时代,其中一个典型特征就是这类文件发布越来越频繁。
药监年度重点发布概览:药学研究 药学研究的指南体系已经相当成熟,业界在开展工艺、质量标准和分析方法研究时,已经习惯于采用ICH的指南。监管机构发文侧重于具体品种和个别主题。本文还纳入了代表性较强的药典更新。FDA多次以MAPP(用于FDA CDER内部员工使用的政策程序手册)的形式发布药学研究内容,同样具有指南的价值。
药监年度重点发布概览:注册与变更 由于工作流程类似,尽管变更的文件通常也包含药学内容,本文还是将其与注册放在一起。
药监年度重点发布概览:生产质量 本分类涵盖广泛,包含生产质量、质量管理、质量控制,以及检查。
药监年度重点发布概览:经营使用与药物警戒 从数量上,经营使用和药物警戒难与上面几个类别相比。由于两者主要针对上市后监管,因此放在一起。
以上图表和简要分析,并非严谨学术研究,仅从识林视角,为大家回顾2024制药业法规指南全景提供一个参考。2025年,识林将一如既往关注来自更多机构,涵盖更完整主题的法规指南。 监管机构和研究机构在法规指南方面的努力,既是对行业的规范和引导,也源自产业的需求和激励。这种激励,体现在业界对法规指南的关注和尊重,并能基于科学和风险运用法规指南。业界有此务实心态,识林和更多志同道合的业务机构和专家所开展的各类法规指南研究工作,才更有价值。 作者:识林-实木 识林®版权所有,未经许可不得转载。 必读岗位及工作建议:
适用范围: 文件要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 法规指南解读适用业务范围和企业类型 本文件《中药药效学研究技术指导原则征求意见稿》主要适用于涉及中药药效学研究的药企,包括但不限于中药创新药、中药改良型新药、中药仿制药等。文件内容涉及的药品类型为中药,适用于在中国市场的药品注册和监管。企业类型包括Biotech、大型药企、跨国药企以及从事中药研发的CRO和CDMO等。 适用岗位 该文件将对药企中负责药品研发、注册、质量控制、临床试验等岗位的工作产生影响。特别是研发部门、注册事务部门、质量管理部门和临床研究部门的工作人员需要仔细阅读并理解文件内容,以便在中药药效学研究中遵循相关指导原则。因此,这些岗位的工作人员应将此文件视为“必读”。 文件要点总结
通过以上解读,药企相关岗位的工作人员应能够更好地理解并应用《中药药效学研究技术指导原则征求意见稿》中的内容,以确保中药药效学研究的合规性和有效性。 适用岗位:必读岗位包括研发(R&D)、临床(Clinical)、注册(Regulatory Affairs)、质量管理(QA)。
适用范围:本文适用于在中国境内获得临床试验默示许可的生物制品,包括预防用生物制品和治疗用生物制品,涉及从临床试验默示许可后到提交上市许可申请前的整个“临床试验期间”发生的药学方面的变化和/或更新。适用于Biotech、大型药企、跨国药企等。 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
适用范围说明: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位
工作建议
适用范围 文件要点
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读指南:
工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位与工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
工作建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 解读指南:EMA《活性物质的化学指南》 必读岗位建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
EHS专员工作建议:
注册专员工作建议:
研发人员工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位建议:
工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议
文件适用范围本文适用于指导行业开发体外制造的嵌合抗原受体(CAR)T细胞产品,特别针对用于治疗肿瘤(包括血液恶性肿瘤和实体瘤)的生物制品。适用范围包括自体和异体CAR T细胞产品,由美国食品药品监督管理局(FDA)发布。 文件要点总结
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位建议:
适用范围说明: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 法规指南解读必读岗位
工作建议
文件适用范围本文适用于美国FDA监管下的注射剂和生物制品,包括创新药、仿制药、生物类似药等。主要针对液体和固体需要重构的药物产品,特别关注小瓶包装形式。 文件要点
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 本文适用于化学药和生物制品,主要针对肿瘤治疗药物的剂量优化。适用于创新药和生物类似药,由美国FDA发布,适用于Biotech、大型药企、跨国药企等。 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结: 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位
工作建议
文件适用范围本文适用于全球药品监管机构和制药行业,针对使用真实世界数据(RWD)进行药品安全性评估的药物流行病学研究。涉及药品类型包括化学药、生物制品、疫苗等,不包括中药。适用于创新药、仿制药、生物类似药和原料药等注册分类。主要针对大型药企、Biotech公司、跨国药企、CRO和CDMO等企业类别。 文件要点总结
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 【文件概要】 【适用范围】 【影响评估】 【实施建议】
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
结语:以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读指南
文件适用范围本文适用于化学药、生物制品、疫苗和中药等药品类型,特别针对创新药、仿制药、生物类似药及原料药等注册分类。由NMPA(中国国家药品监督管理局)发布,适用于Biotech、大型药企、跨国药企、CRO和CDMO等企业类别。 文件要点总结准入审批类应用
日常监管类应用
服务公众类应用
辅助决策类应用
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
结语:以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 文件要点:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 本文适用于所有在美国市场销售的化学药品和生物制品,包括创新药和仿制药。发布机构为美国药典(USP),企业类别包括Biotech、大型药企、跨国药企以及CRO和CDMO等。 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
工作建议:
适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 WHO GMP 考虑要点:预防和控制药品中亚硝胺污染 适用岗位(必读):
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议
文件适用范围本文适用于中药、化学药(含原料药)、生物制品及体外诊断试剂的注册检验,包括创新药、改良型新药、生物类似药等。适用于中国境内药品检验机构,包括国家级、省级和口岸药品检验机构,以及涉及药品注册检验的企业。 文件要点总结
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位:
工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位:
适用范围: 文件要点总结: 以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
适用范围说明: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 适用岗位与工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
文件适用范围: 要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 岗位必读建议:
文件适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 必读岗位及工作建议:
适用范围: 文件要点总结:
以上仅为部分要点,请阅读原文,深入理解监管要求。 |