
|
欧盟重申与美国 FDA 在新冠疫苗毒株选择上的分歧
2024.07.23
欧洲药品管理局(EMA)于 7 月 19 日再次确认,其秋季新冠(COVID-19)疫苗毒株选择将与美国 FDA 的选择略有不同,具体取决于进一步的批准。
根据世界卫生组织(WHO)4 月份的建议,EMA 表示将坚持其工作组的建议:最新的新冠疫苗针对奥密克戎(Omicron)的 JN.1 家族。7 ...
|

|
前辉瑞统计学家被指控对新冠特效药Paxlovid临床试验结...
2023.06.30
6 月 29 日,前辉瑞统计学家因根据有关 Paxlovid 新冠治疗药临床试验结果的预先信息采取行动而被美国当局指控犯有内幕交易罪。
美国证券交易委员会(SEC)称,43 岁的 Amit Dagar 曾担任该试验的高级统计项目负责人,在 2021 年 11 月 5 日结果公布之前交易了辉瑞股票。...
|
|
FDA 专家会建议更新新冠疫苗配方以针对最新奥密克戎...
2023.06.16
根据美联社消息,美国 FDA 于 6 月 15 日召开的专家会表示,美国下一轮新冠疫苗应该只包含对目前在全球范围内占主导地位的最新变种(奥密克戎家谱的一个分支 XBB)的保护。FDA 将作出最终决定。疫苗商在会上表示,可能会在几个月内更新可用疫苗,具体取决于毒株。
目前的新冠疫...
|
|
【识林专题】疫情期间和疫情后恢复生产内容汇总
2022.12.23
专题汇总了识林中关于指导疫情期间和疫情后企业恢复生产相关的内容。包括国内外重要法规指南、指导文件、视频、相关资讯等,希望为企业在疫情期间和疫情后复工复产提供参考。
由于篇幅所限,本文仅摘录目录及指南名称,完整带链接专题可点击阅览
法规指南 — 国内药监
北京市...
|
|
FDA 授权针对新冠奥密克戎变种的加强疫苗,尚无新的...
2022.09.01
美国 FDA 于 8 月 31 日宣布授权 Moderna 和辉瑞的针对新冠原始毒株和奥密克戎变种的二价 mRNA 疫苗加强针。辉瑞及其合作伙伴 BioNTech 的二价加强针被授权用于 12 岁及以上人群,Moderna 的被授权用于 18 岁及以上人群。
新加强疫苗的开打仍需等待美国疾病控制和预防中心(...
|

|
人类面临病原体的灾难性威胁,制定大流行病国际条约迫...
2022.08.31
为什么说“人们正面临病原体所构成的灾难性威胁”,我们可以联想一下席卷全球绝大部分国家的新冠疫情,可以说任何一个人都无法独善其身!疫情这三年,无论是对全球人们而言、还是对各国国家而言,都是一场十足的阻击战、攻坚战,与此同时,它也是一场持久战、消耗战。然而,世界目前所经受...
|
|
低覆盖,资金难,拜登政府仍打算开发下一代新冠疫苗
2022.07.28
近日,为降低新冠病毒COVID-19感染和死亡率,拜登政府正在准备一项开发下一代COVID-19疫苗的相关工作。目前,涉及COVID-19疫苗的相关工作的联邦官员、冠状病毒方面的顶级科学家和包括Pfizer和Moderna代表在内的制药高管正准备去白宫参加疫苗开发的相关会议,讨论COVID-19疫苗开发的新...
|

|
新冠挑战,资源挤占,数据可靠性,WHO倡议加强全球临...
2022.06.06
新冠肺炎疫情对全球临床试验产生了深远影响。COVID-19疫苗和疗法的研发如火如荼,但其他治疗领域的临床试验却受到了相当大的干扰,尤其是心血管、皮肤病学和代谢学。虽然FDA和EMEA等重要监管机构均推出了维护临床试验完整性的指导方针和措施,试图在COVID-19大流行期间保障患者和医护人...
|
|
单抗下课,疫苗常态化?-- FDA高管表示秋季可能会...
2022.04.13
在3月29日,FDA批准第四剂莫德纳和辉瑞 -BioNTech COVID - 19 疫苗。几小时后,FDA 生物药品评价和研究中心(CBER)主任 Peter Marks在线上交流中表示第五剂疫苗(第三轮加强针)可能会在秋季获批。
“我不想吓到任何人,但是在秋季人们可能需要再来一剂加强针。”他进一步补...
|

|
国际药政每周概要:ICH更新Q2方法验证,发布Q14方法开...
2022.04.05
【注册、审评、审批】
3.31,【FDA】PQ/CMC(药品质量/化学,生产与控制)项目启动
4.01,【FDA】GDUFA II/BsUFA II/PDUFA VI 2018-2022 五年财政计划 2022年更新
其他动态
【cGMP与全球检查】
【临床研究与临床用药】
【CMC研发与制造】
4.01,【ICH】《Q...
|

|
美国防治新冠的经费快用完了
2022.03.31
美国时间3月29日,美国FDA紧急授权使用新冠疫苗的第二加强针(请参考今天的另一篇识林资讯《新冠疫苗第二增强针(第四针)获FDA授权》)。政府这样做是为给民众多一层抵抗新冠病毒的免疫保障,体现了对民主健康的关注。但同一天,曾任FDA局长、现任美国政府新冠响应小组首席科学官的David...
|
|
新冠疫苗第二增强针(第四针)获FDA授权
2022.03.31
美国时间3月29日,针对50岁及以上的人群,FDA授权辉瑞和莫德纳核酸疫苗的第二增强针。
这是紧急授权,不是批准。尽管辉瑞和莫德纳的疫苗都获得了FDA的正式批准,但仅是针对疫苗接种的第一和第二针的。这两个疫苗的第三针,也称增强针,以及今天批准的第四针,也称第二增强针,都只是获...
|

|
疫情过后企业有机会继续与 FDA 在线上开会?
2022.03.07
新冠疫情曾导致FDA暂停线下会议,改用视频会或电话会。尽管效果并不尽如人意,大多数情况下申请人还是能够得到有效的反馈。随着美国疫情政策逐步放松,线下会议将逐步恢复。
加强沟通是FDA领导层的共同愿望
尽管 FDA 前任局长Gottlieb日前表示,线下会议在审评周期中的重要性无可...
|

|
FDA 公开劝阻企业开发或申请新冠相关“消毒通道”
2022.02.14
美国 FDA 于 2022 年 2 月 8 日发布题为《关于新冠(COVID-19)相关消毒通道的新冠公共卫生紧急政策》指南,公开劝阻申办人开发消毒通道或寻求消毒通道的批准或授权。消毒通道(或消毒隧道、卫生通道)是使用传感器喷嘴向人(及其衣物)喷洒消毒剂或雾化抗菌剂喷雾的通道、走廊、...
|
|
FDA 宣布推迟下周针对辉瑞幼儿新冠疫苗的专家会
2022.02.12
美国 FDA 于 2022 年 2 月 11 日下午表示,取消原定于下周召开的讨论辉瑞幼儿新冠疫苗的专家委员会,以“给 FDA 时间考虑更多数据。”
FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 和 FDA 代理局长 Janet Woodcock 在一份声明中表示,“基于 FDA 的初步...
|
|
FDA 发布指南试图缓解毒性研究猴子短缺问题
2022.02.08
美国 FDA 于 2 月 4 日发布了一篇题为《缓解因 COVID-19 大流行引起的非人类灵长类动物供应限制的非临床注意事项》的新指南,帮助研究人员应对与新冠疫情相关的用于进行非临床毒性研究的猴子供应短缺挑战。
目前有数百种针对新冠及相关疾病的药物和疫苗在研,每一个都必须在人...
|

|
罕见之举:FDA 主动要求辉瑞提交幼儿新冠疫苗 EUA ...
2022.02.03
美国 FDA 于 2 月 1 日下午罕见地要求辉瑞公司提交滚动申请,修订其新冠疫苗紧急使用授权(EUA)以包括 6 个月至 4 岁年龄段的儿童。
而与之相对,上个月,辉瑞宣布其疫苗(适用于最年幼人群的 3 µg 剂量)与已证明高有效性的 16 至 25 岁人群相比,对 6 至 24 ...
|
|
辉瑞和 BioNTech 对奥密克戎新冠疫苗开展临床试验,...
2022.01.26
辉瑞和 BioNTech 公司于 2022 年 1 月 25 日在一份声明中表示,他们已经开始一项研究将基于奥密克戎的新冠疫苗与原始疫苗进行比较。辉瑞表示,预计该研究的初步结果将在 2022 年上半年出来,这项研究预期招募 1420 名志愿者。
如果监管机构等待此类研究的数据,这可能意味...
|
|
礼来和再生元新冠治疗性单克隆抗体对奥密克戎无效,FD...
2022.01.25
美国 FDA 限制由再生元(Regeneron)和礼来公司生产的两种新冠治疗性单克隆抗体的使用,称这两种新冠治疗药不应在任何州使用,因为其对目前主要的奥密克戎变种无效。
FDA 于 2022 年 1 月 24 日修订了对两种新冠治疗性单克隆抗体的紧急使用授权 — 礼来的 bamlanivimab 和 etes...
|
|
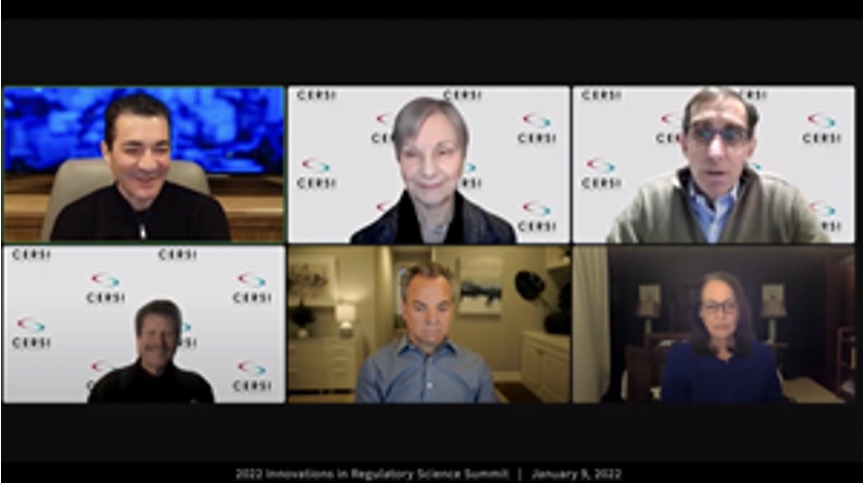
前任现任未来 FDA 局长齐聚一堂,剖析大流行应对措...
2022.01.19
2022 年 1 月 9 日,一个由前任美国 FDA 局长、现任 FDA 代理局长以及未来提名 FDA 局长组成的小组讨论了 FDA 在应对当前和未来流行病方面的作用,以及他们对 FDA 近期的展望。
专家们在加州大学旧金山分校-斯坦福监管科学与创新卓越中心(CERSI)的监管科学创新峰会上...
|