
|
ICH 正式发文计划协调仿制药标准
2019.02.08
ICH 于 2 月 6 日发布了一份思考性文件(reflection paper),概述了关于跨国协调仿制药技术和科学标准的思考。
该文件建议对非复杂制剂和复杂制剂制定一系列证明生物等效性标准的 ICH 指南。文件还介绍了将于 2019 年组建的非正式仿制药讨论组(Informal Generic drug Discussion...
|

|
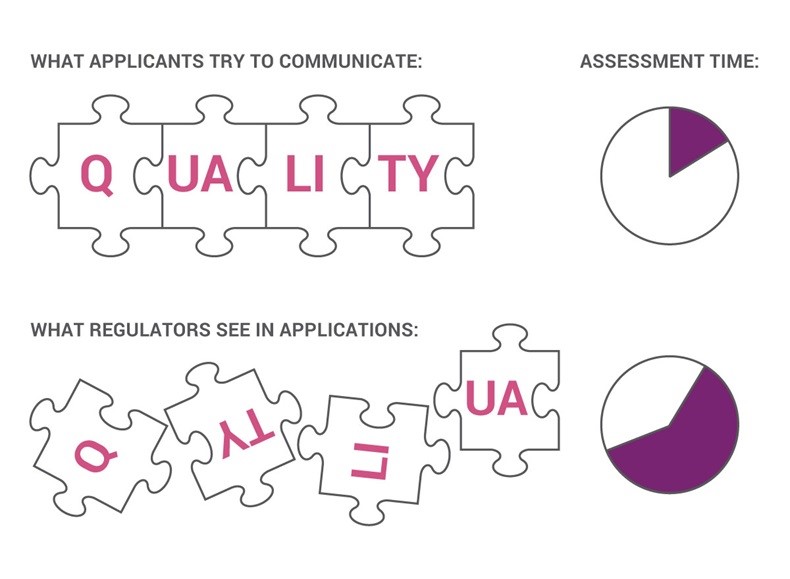
ICH 仿制药标准:知易行难的计划
2018.12.04
美国FDA在今年十月间宣布向国际人用药技术要求协调会(ICH)提交了一份制定全球通用的仿制药标准的方案。这一方案是FDA局长Gottlieb提出的旨在解决仿制药行业中药品竞争和可及性问题《药品竞争行动计划》(Drug Competition Action Plan)中的另一项战略。【FDA 向 ICH 提议协调全球...
|

|
ICH 是否真地实现了全球协调?
2018.11.13
全球监管机构的协调统一并不是件易事,首先各机构对于同一概念的定义就有所不同,更不用说各国的法规要求和监管传统。仿制药界资深人士 Bob Pollock 给我们带来了他在第四届全球监管事务 CMC 会议上对于 ICH 指南在各国协调实施过程中存在的问题的观察。会议于 10 月 29 -30 ...
|

|
FDA 向 ICH 提议协调全球仿制药批准标准
2018.10.20
美国 FDA 于 10 月 18 日宣布正在向 ICH 提出一项建议更好地协调仿制药的科学和技术标准。该提议旨在允许仿制药研发商实施单一的全球药物研发计划以及提交申请的通用要素,以在多个市场同时批准。
FDA 局长 Scott Gottlieb 表示,“这将使原本只在一个地区寻求仿制药批准的...
|

|
FDA 元素杂质定稿指南发布
2018.08.08
美国 FDA 于 8 月 7 日发布《成品药中的元素杂质》定稿指南【中译】,解释了何时对成品药中的元素杂质开展风险评估。该指南定稿了 2016 年 6 月 30 日发布的草案文件。2018 年 1 月 1 日,ICH Q3D 元素杂质指南与美国药典通则和 同时生效,控制成品药中的元素杂质。定稿指南...
|

|
业界探讨如何使 ICH Q12 的价值最大化
2018.08.07
行业正在探索 ICH Q12 生命周期管理概念如何在内部实施中以及在与监管机构的互动中最大化实践价值。ICH 专家工作组(EWG)成员鼓励业界与工作组分享其经验、实施挑战以及如何改进指南草案。工作组还有兴趣听取行业对于证明有效的实施策略的反馈,从而可以作为培训工作的一部分更广泛地...
|

|
起始物料难题新进展 — ICH最新培训资料中文版
2018.07.25
2018 年 7 月 20 日,ICH 发布了《Q11 Q&As原料药的起始物料的选择与论证》培训材料,ICH 在 2012 年 5 月和 2017 年 8 月就分别发布了 Q11 和 Q11 Q&A 指南,但从 ICH Q7 开始,起始物料问题就一直是原料药的开篇难题,这份培训资料探讨了下列问题:
化学合成...
|

|
ICH Q12 在各监管机构的征求意见时间表
2018.06.06
2017 年 12 月,ICH 网站发布了 ICH Q12 《药品生命周期管理的技术和监管考虑》指南征求意见稿,截止目前,ICH 的监管机构成员征求意见的截止时间见下表。
+ICH Q12 在各监管机构成员中的征求意见时间表
!机构
!征求意见稿发布时间
!截止时间
!详细通知文件
EMA(欧盟)
2017...
|

|
FDA最新元素杂质要求受到质疑
2018.03.05
美国FDA对药品的最新要求是元素杂质方面。自2018年1月1日起,USP 、元素杂质要求正式生效,将适用于所有的USP各论品种。并且从该日期起,所有新获得批准的ANDA均需要符合USP。在2018年2月7日的文件中, OGD建议ANDA申请人以主动提供的增补(unsolicited amendment)提交所需的元素杂质...
|

|
FDA 与业界对 ICH Q12 中基于性能的已建立的条件...
2018.02.22
制药行业人员对于在国际协调理事会(ICH)关于批准后变更的 Q12 指南中列入基于性能(performance-based )的已建立的条件(established conditions,EC)表示支持。这种方法使制造商在对已获批产品做生命周期生产变更时有更大灵活性,而无需事先获批监管机构的批准。
美国 FDA ...
|

|
FDA 发布关于申请人何时提交元素杂质数据的指导
2018.02.07
美国 FDA 仿制药办公室(OGD)要么听到了来自业界的建议,要么主动决定向 ANDA 申请人提供关于处理提交文件以满足元素杂质问题的最佳方式的指导。【元素杂质实施截止日期导致 FDA 仿制药批准下降? 2018/01/20】 OGD 于 2 月 7 日发布了关于“申请人决定何时向 FDA 提交...
|
|
FDA 倡导改进申报资料中的质量综述内容
2018.02.01
美国 FDA 希望通过要求申办人更好地利用通用技术文件(CTD)的质量综述,加快 NDA 和 ANDA 审评并为最终 ICH 的采纳奠定基础,CTD 质量综述可以使 FDA 审评人员关注患者影响和其它关键因素。
美国 FDA 邀请制药企业探索使用质量综述(QOS)的新方法,以加强和加快新药和仿...
|

|
元素杂质实施截止日期导致 FDA 仿制药批准下降?
2018.01.20
2018 年 1 月到目前为止美国 FDA 对新仿制药申请的批准并没有很多,截至 1 月 16 日仅批准了 4 件 ANDA,这可能与 1 月 1 日起生效的有关元素杂质文件的新 USP 要求有关,至少部分完全回应函(CRL)的原因是 USP 元素杂质的新要求。
FDA 在一份声明中表示,“一月...
|

|
ICH 正在制定局部用药品的元素杂质每日允许暴露量
2017.12.10
ICH 专家工作组正在起草指南设定局部用药品元素杂质的每日允许暴露量(PDE)。有关元素杂质皮肤吸收数据的缺乏仅是工作组成员根据 ICH Q3D 指南制定 PDE 限度指南所面临的挑战之一。尽管如此,工作组正在努力前进,并计划于 2018 年 5 月准备好第 2 阶段文件向公众征求意见,计划于...
|

|
监管机构对新药元素杂质风险评估的评价褒贬参半
2017.11.20
ICH Q3D 元素杂质指南于 2016 年 6 月对新药生效,但到目前为止似乎还没有完全解决对药品中存在元素杂质的担忧。来自欧洲药品管理局(EMA)和加拿大卫生部的监管者对于为符合 ICH Q3D 指南而在新药申请中提交的元素杂质风险评估质量给出了不同的评价。
在 11 月 2 日由药品质...
|

|
制药商应生成自己的元素杂质数据以符合 ICH Q3D
2017.11.13
11 月 2-3 日由药品质量研究学会(PQRI)和美国药典(USP)主办的 ICH Q3D 的实施会议上,专家表示,根据国际协调理事会(ICH)Q3D 元素杂质指南,制药商不应该依赖从辅料或原料药供应商那里获得的信息来完成所要求的风险评估。相反,他们应该依靠自己的内部检测计划或公开文献。...
|

|
ICH Q11 起始物料选择和论证问答指南定稿
2017.09.09
ICH 已完成期待已久的 Q11 问答文件,关于企业应如何选择和论证其用于生产原料药的起始物料。问答文件旨在解决自 2012 年 5 月已经实施的 ICH 关于原料药研发和制造的现有 Q11 指南。
ICH 表示,在全球范围内实施 Q11 指南的经验“引发了与起始物料选择和论证有关的澄清...
|

|
ICH 2017年5月蒙特利尔会议简报
2017.06.19
译自 ICH 新闻稿:Press release ICH Assembly meeting in Montreal, Canada, May/June 2017
国际协调理事会(ICH) 于 2017 年 5 月 27 日至 6 月 1日在加拿大蒙特利尔举行会议。ICH 大会批准了中国食品药品监督管理总局(CFDA)成为新的监管机构成员,PIC/S 成...
|

|
有感于我国加入 ICH
2017.06.02
新药研发是大科学,大到有时难以用传统科学方式来评判。例如,传统科学实验结果应能为他人异地所重复,同行评议有实效。但新药临床试验结果往往难以重复,因其药学(CMC)及疗效评估的具体数据都不公开,动辄上亿美元的试验费用也令人却步。
10 年前,我国药品监管领域的一位前辈曾指...
|

|
对已获批产品元素杂质要求的实施建议
2017.04.25
随着对于已获批产品的元素杂质要求实施日期的临近,尚未开始风险评估以使现有药品符合国际协调理事会(ICH)Q3D 元素杂质指导原则要求的企业最好现在就开始行动。
百时美施贵宝(BMS)公司分析化学家 Nancy Lewen 于 3 月 23 日在第三届 FDA/PQRI 促进产品质量年会上对于已...
|