
|
欧盟官员表示 ICH Q6B 生物制品检测方法和可接受标...
2021.12.07
瑞典医疗产品管理局疫苗和单克隆抗体(MAb)高级专家 Mats Welin 在 2021 年 11 月 30 日由国际制药工程协会(ISPE)主办的关于以患者为中心的质量标准网络研讨会上表示,ICH Q6B《质量标准:生物技术产品及生物制品的检验方法和接受标准》设定了新生物制品的可接受标准,需要修...
|

|
ICH 2021 年 11 月大会公布最新指南进展和下一步...
2021.11.27
ICH 大会于 11 月 17 日至 18 日通过网络召开,会议之前是 ICH 管理委员会和 MedDRA 管理委员会网络会议。
大会上 ICH 进一步扩大了会员和观察员。墨西哥 COFEPRIS 成为新的 ICH 成员,此外还有三个新的 ICH 观察员:埃及 EDA,印度尼西亚 FDA 以及乌克兰 SECMOH。目前...
|

|
ICH 正修订 E2D 上市后安全数据管理指南,协调处理...
2021.11.26
ICH 正在准备更新 E2D《上市后安全数据管理》指南,帮助公司处理来自越来越多来源的批准后安全数据。
ICH E2D(R1) 专家工作组报告员、AbbVie 卓越药物警戒副总裁 Vicki Edwards 在 10 月初 DIA 药物警戒受权人(QPPV)论坛上表示,正在考虑采取多种方法更新关于批准后安全数...
|

|
行业组织就 ICH Q12 实施细节向 FDA 提交反馈意...
2021.10.30
国际制药工程协会(ISPE)正在呼吁美国 FDA 对 ICH Q12 批准后变更指南进行多处修订。FDA 于今年 5 月发布 Q12 实施考量指南草案并公开征求意见。
ISPE 在其 10 月 8 日的反馈意见中提出,拟议报告类别应放在通用技术文件(CTD)的区域性信息部分,而不是模块 3 中。ISP...
|

|
ICH Q9 质量风险管理指南修订将推迟三个月,解决风...
2021.10.15
ICH Q9《质量风险管理》指南的修订由于新冠疫情已推迟了大约三个月,但修订过程仍在继续推进。
爱尔兰卫生产品监管局高级 GMP 检查员 Kevin O'Donnell 在 9 月 30 日的 PDA/FDA 联合监管会议上表示,这将是“非常有针对性的修订。我们不会修改指南的许多方面,这绝不是完...
|

|
ICH 发布 E8(R1) 临床研究的一般考虑指南
2021.10.12
ICH 于 10 月 6 日宣布,E8(R1)《临床研究的一般考虑因素》指南已达到第 4 阶段,正在等待各监管机构批准采纳。这份广受期待的指南通过采用质量源于设计的原则,使临床试验的设计、实施和报告现代化。指南结合了“实现符合预期目的的数据质量的当前概念。”
ICH 表示,“ICH E...
|

|
ICH 调研显示指南实施和采纳水平普遍较高
2021.09.22
根据 9 月 9 日公布的一项最新调研结果显示,ICH 的 55 份与质量、安全性和有效性相关的指南以及多学科指南中的大部分已被其 10 个非创始成员和观察员以及 30 家制药企业采纳。
该调研旨在监测监管机构和行业对 ICH 指南实施的充分性和水平,并补充 2019 年发布的关于 I...
|

|
业界要求 FDA 进一步澄清 ICH Q12 的既定条件、...
2021.08.10
美国 FDA 于今年 5 月发布《ICH Q12:FDA 监管产品的实施考量》指南草案向利益相关者征求反馈意见【FDA 发布 ICH Q12 实施考量指南,详述如何实施既定条件并提供示例 2021/05/16】,反馈截止日期为 7 月 19日,FDA 收到了包括来自制药行业贸易协会以及单独企业的https//www.regulat...
|
|
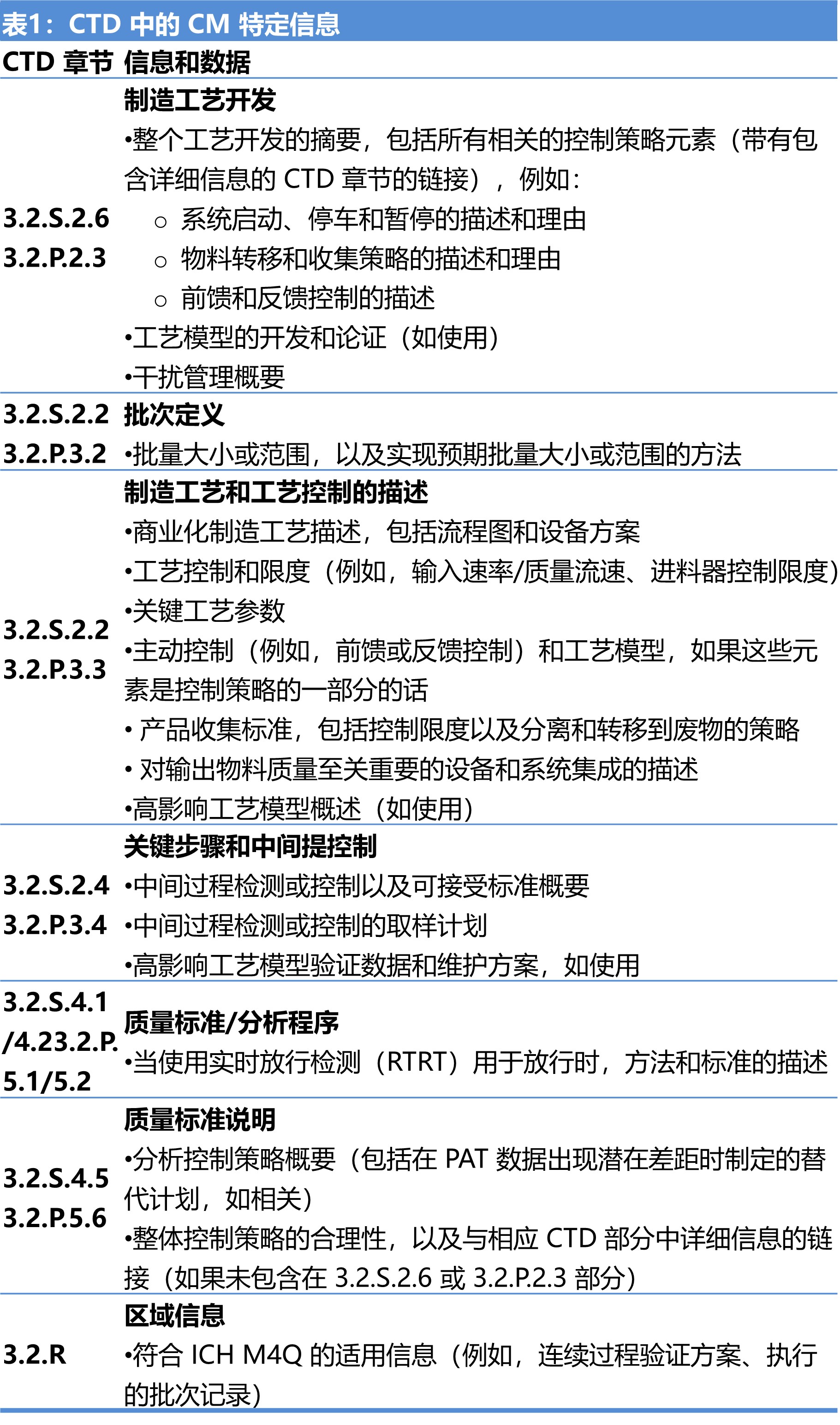
ICH Q13 连续制造指南正式发布
2021.07.29
ICH 于 7 月 27 日正式发布了广受期待的 Q13 《原料药与制剂的连续制造》指南,公开征询意见。指南“描述了连续制造(CM)的开发、实施、操作和生命周期管理的科学和监管考虑因素。”指南还“澄清了 CM 的概念,描述了科学方法,并提出了针对原料药和制剂连续制造的监管考量。”...
|

|
ICH Q13 连续制造指南即将发布
2021.07.17
ICH Q13 关于连续制造的指南预计将很快发布征询反馈意见。7 月 14 日,由加州分离科学学会(CASSS)主办的 CMC 战略论坛上,美国 FDA 药品质量办公室生物技术产品办公室审评员 Cyrus Agarabi 概述了 ICH Q13 指南的最新进展。Agarabi 是 FDA 连续制造团队的成员之一。
IC...
|

|
ICH 公布以患者为中心的药物开发思考性文件意见征询...
2021.06.28
ICH 以患者为中心的药物开发(PFDD)思考性文件于 2020 年 11 月获得 ICH 大会批准【ICH 将着手制定以患者为中心的药物开发指南 2020/12/12】,确定了纳入患者观点可提高药物开发的质量、相关性、安全性和有效性,并为监管决策提供信息的关键领域。思考性文件还提出了制定新 IC...
|

|
ICH 计划制定使用真实世界证据的药物流行病学研究新...
2021.06.17
随着人们对使用真实世界数据(RWD)以更好地了解药物安全性的兴趣日益浓厚,ICH 考虑需要就该主题制定统一的指南。
最近于 6 月 2-3 日在线举行的 ICH 2021 年第一次大会上,ICH 大会成员支持需要就“利用真实世界数据进行药物安全性评估的药物流行病学研究的规划和设计一般...
|

|
FDA 启动全球仿制药集群,协调仿制药开发和监管方法
2021.06.17
为促进全球监管机构对仿制药开发的科学和监管方法的协调一致,美国 FDA 正在建立一个仿制药集群(Generic Drug Cluster)。
FDA 于 6 月 14 日在其社交媒体账户上宣布启动仿制药集群,新集群被描述为“在世界领先的监管机构中建立的第一个解决全球仿制药开发问题的论坛”,旨...
|
|
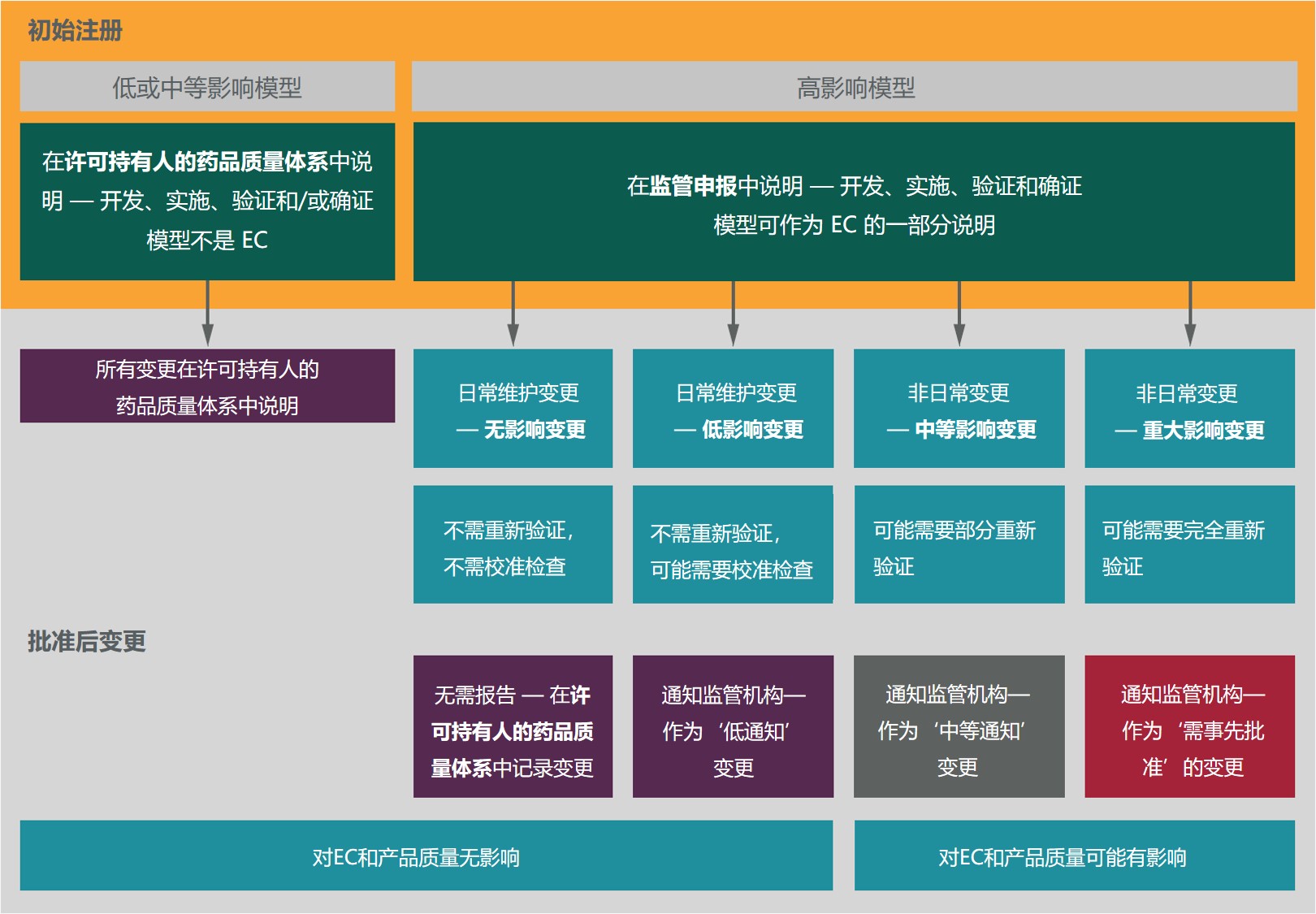
行业组织建议 ICH 降低对制造模型的监管监督,以期...
2021.05.27
最近几个行业组织共同制定了一项提案,用于管理对制药生产过程中使用的模型的监管监督,提出即使对于那些对药品生产有重大影响的模型也可以放松监管使用次要变更途径。
这几个行业组织分别是:BioPhorum、国际药物开发创新和质量联盟(IQ 联盟)以及制药过程分析圆桌会议(PPAR)。他...
|

|
FDA 发布 ICH Q12 实施考量指南,详述如何实施既...
2021.05.26
美国 FDA 于 5 月 20 日发布《ICH Q12:FDA 监管产品的实施考量》指南草案,向制药商解释了如何在各类申请,包括新药申请(NDA)、生物制品许可申请(BLA)以及简化新药申请(ANDA)中提交既定条件(Established Conditions, EC),以及对 EC 的变更报告类别如何确定,以帮助制药商...
|

|
ICH 将于年底发布模型引导的药物研发(MIDD)概念文...
2021.05.25
监管机构对模型引导的药物研发(Model-informed Drug Development, MIDD)计划的兴趣日渐浓厚,但目前仍存在一些障碍,阻碍了 MIDD 计划的更广泛采纳。
美国 FDA 和加拿大卫生部于 5 月 14 日举办了 ICH 区域公开会议,提供了有关当前 ICH 主题的最新信息。会上辉瑞英国研发执行总...
|

|
【周末杂谈】ICH M9,创新与监管科学
2021.05.23
从CMC的角度看,创新药与仿制药的研制有那么不同吗?
5月11日,美国FDA发布了题为“M9 基于BCS分类的生物等效豁免(M9 Biopharmaceutics Classification System-Based Biowaivers)”。其实这就是ICH指导原则 M9。三年前,FDA就发布这个指南征求意见稿了。这次,几乎未作任何修...
|

|
ICH 发布药物致癌性试验指南附录,建议减少大鼠致癌...
2021.05.17
ICH 于 5 月 10 日发布了 S1B(R1)《药物致癌性试验指南附录》,提出了“证据权重”方法来指导为期两年的大鼠研究是否会增加评估药物致癌风险的价值。
拟议指南为正在考虑是否需要啮齿动物研究评估致癌性的药物开发人员提供了更详细的指导。2012 年 6 月,ICH 指导委员会批...
|

|
ICH 起草临床试验管理规范(GCP)指南现代化原则
2021.04.21
ICH 于 4 月 19 日发布了 E6(R3)临床试验管理规范(GCP)总体原则草案,这些原则将构成其修订 GCP 指南的基础。
ICH E6(R3) 专家工作组正在修订 E6(R2) GCP 指南,以期将 GCP 原则应用于越来越多样化的用以支持监管和医疗保健相关药品决策的试验类型和数据源,用...
|

|
使用 ICH Q12 方案简化分析方法的批准后变更,道阻...
2021.02.17
“人们普遍认为,PACMP 不会真正减少批准后的变更活动”
ICH Q12 指南实施工作组成员在 2 月 4 日的美国药典(USP)会议上表示,制药行业应利用 Q12 指南中有关批准后变更管理方案(PACMP)的规定促进分析方法的变更。
工作组成员、辉瑞工艺知识高级主管 Graham Cook 表...
|