
|
美加英三国联合发布医疗器械开发机器学习质量规范十项...
2021.10.28
美国 FDA、加拿大卫生部(HC)以及英国 MHRA 共同确定了 10 项指导原则,为机器学习质量管理规范(Good Machine Learning Practice,GMLP)的制定提供指导pdf。这些指导原则将有助于推广使用人工智能和机器学习(AI/ML)的安全、有效和高质量的医疗器械。
人工智能和机器学习...
|

|
FDA 发布医疗器械 De Novo 分类最终规定
2021.10.07
美国 FDA 于 10 月 4 日发布了一项最终规定,为医疗器械 De Novo 分类过程设定了要求,对新类型医疗器械被授权为 I 类或 II 类器械编制了程序和标准。
De Novo 分类通道是针对一些无法确定实质等同的低风险和中等风险器械的监管路径。De Novo 通道覆盖采用新型技术或组件...
|

|
FDA 服从法院裁决,将造影剂等药物转为器械监管
2021.08.11
美国 FDA 于 8 月 9 日向利益相关者和公众发布通告,表示将很快开始执行一项法院裁决,该裁决可能要求 FDA 将一些作为药物批准的产品转变为作为器械进行监管。
今年 4 月,FDA 在美国哥伦比亚特区巡回上诉法院的一场官司中败诉,因为 FDA 辩称自己作为监管机构,由于“药...
|

|
FDA 疫情期间放松数字疗法规定,抑郁症治疗处方应用...
2021.07.23
最近以消费者健康应用程序而闻名的 Happify Health 宣布将利用疫情期间放松的 FDA 法规推出新的处方软件来治疗抑郁症。
Happify 成立于 2012 年,最近宣布已筹集了 7300 万美元加强其在数字治疗领域的工作。随着资金雄厚的公司向监管机构、保险公司和临床医生证明软件可被用...
|

|
FDA 警告意大利医疗器械环氧乙烷灭菌公司,涉嫌伪造...
2021.06.05
美国 FDA 于 6 月 2 日在给医疗器械制造商的一封https//www.fda.gov/medical-devices/industry-medical-devices/sterility-issues-medical-devices-processed-steril-milano-facilities-letter-industry?utm_medium=email&utm_source=govdelivery 公开信中表示...
|

|
FDA 失去对器械或药品认定的灵活性,法院裁定造影剂...
2021.04.26
美国联邦哥伦比亚特区巡回上诉法院于 4 月 16 日在对 FDA 的裁决中确定放射性扫描期间使用的造影剂在法律上是一种器械而不是药物。如果 FDA 将产品作为医疗器械而不是需要 FDA 上市许可的药品进行监管,则对医疗产品制造商来说监管成本将大大降低。
这一裁决标志着 Genus ...
|
|
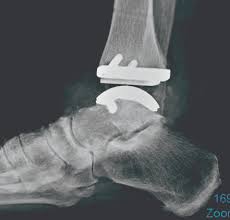
FDA 批准世界首个 3D 打印距骨植入物用于罕见骨病
2021.02.18
美国 FDA 于 2 月 17 日宣布批准了 Additive Orthopaedics 公司的患者特制距骨垫片(Patient Specific Talus Spacer)3D 打印距骨植入物用于人道主义用途。患者特制距骨垫片是世界上首个,也是同类首个用于替代距骨(连接腿和脚的踝关节中的骨骼)的植入物,用来治疗踝关节缺血...
|

|
FDA 发布首份人工智能和机器学习行动计划
2021.01.13
美国 FDA 于 1 月 12 日发布了首份《基于人工智能/机器学习(AI/ML)的软件作为医疗器械(Software as a Medical Device, SaMD)行动计划》。行动计划介绍了多管齐下的方法,推进 FDA 对基于 AI/ML 的医疗软件的监督。
FDA 医疗器械与放射健康中心(CDRH)数字医疗卓越中心主...
|

|
FDA 发布医疗器械场地检查定稿指南
2020.07.01
美国 FDA 于 6 月 26 日发布有关医疗器械场地检查的定稿指南,建立了对器械场地检查的标准时间表,并介绍了检查过程中的标准化沟通方法,以及检查人员和器械场地为促进检查的连续性而需要做的事情。
2017 年《FDA 重授权法案》(FDARA)要求 FDA 发布指南,规定其如何实施适...
|

|
数字疗法:处方视频游戏能赚钱吗?怎么赚?
2020.06.24
一周前,我们介绍了 FDA 批准了第一款基于游戏的数字治疗器械 Endeavor RX,用于治疗儿童注意力缺陷多动障碍(ADHD)。【数字疗法里程碑:FDA 批准首款视频游戏治疗儿童多动症 2020/06/17】获得批准意味着第一道槛过了,那么接下来,处方视频游戏真能赚钱吗?应该怎样赚钱?
作...
|

|
数字疗法里程碑:FDA 批准首款视频游戏治疗儿童多动...
2020.06.17
美国 FDA 于 6 月 15 日https//www.fda.gov/news-events/press-announcements/fda-permits-marketing-first-game-based-digital-therapeutic-improve-attention-function-children-adhd 批准了第一款基于游戏的数字治疗器械,以改善患有注意力缺陷多动障碍(ADHD)儿童...
|

|
器械还是药品?法院限制了 FDA 的自由裁量权
2019.12.27
药品和器械之间的一个关键区别是:药品和器械药遵守不同的监管框架,并且药品的监管繁琐而昂贵。一款仿制药首年的使用者费总计为 30 万美元,而器械仅为 7600 美元左右,而根据 505(b) 途径批准的药品的使用者费更高,2019 财年总计约 250 万美元。另外,药品还需遵守更严格的...
|

|
一次糖尿病监测仪故障带给数字时代的警示故事
2019.12.04
医疗科技的成功也意味着新技术变得不可或缺而且不允许出错。想想看,你可以容忍微信、微博瘫痪的情况,但不能失去使孩子的血糖保持在安全水平的设备。
这是最近几天一家位于圣地亚哥的公司 Dexcom 刚刚发生的事情,该公司生产糖尿病患者使用的用来测量血糖的传感器。Dexcom 一直以来...
|

|
FDA 批准首款可减缓儿童近视进展的隐形眼镜
2019.11.18
美国 FDA 于 11 月 15 日批准了首款可在开始治疗时减缓 8 至 12 岁儿童近视进展的隐形眼镜。这款隐形眼镜名为 MiSight,为一次性使用,用后即抛的软性隐形眼镜,在每天晚上睡前丢弃,不建议配戴过夜。
FDA 器械与放射健康中心(CDRH)眼科、麻醉、呼吸、耳鼻喉科和牙科办公室主任 ...
|

|
FDA 发布系列数字医疗指南澄清重点监管和放权领域
2019.10.01
美国 FDA 于9 月 26 日发布了一系列指南,旨在持续鼓励数字医疗工具的创新方法开发,并确保 FDA 监管这些技术的方法与时俱进。这些指南目的是在加速实验和对人工智能和数字医疗产品投资的同时,在确保安全和支持创新之间寻求微妙的平衡。
这些发布的指南是 FDA “数字医疗创新...
|

|
FDA 对器械监管的年终回顾与展望
2019.02.01
【编者按】随着媒体集体发难以及专家长期对 FDA 医疗器械审批体系的批评,美国 FDA 于去年 11 月宣布计划彻底改革已有数十年历史的医疗器械审批体系,之后发布了一列报告改革行动的声明,但批评者对此并不满意。借此辞旧迎新之机,FDA 局长与器械中心主任再次联合发表声明,回顾...
|

|
FDA 器械监管改革计划受到质疑
2019.01.22
图.BMJ杂志副主编Jeanne Lenzer撰写的The Danger Within US.
批评者认为,医疗器械改革计划并没有触及根本,仍然允许将未经临床试验检验的器械植入体内,对患者造成威胁。批评者提出,为公众获得安全、有效的植入器械,FDA应该将所有植入器械重新定义为高风险或III类产品,使这...
|

|
FDA 表示将彻底改革受到批评的医疗器械体系
2019.01.04
美国FDA官员在2018年11月26日表示,计划彻底改革已经有数十年历史的大多数医疗器械审批的体系。专家们长期以来一直批评该这一体系没有发现有风险的植入物和医疗器械的问题。FDA宣布了旨在确保新医疗器械能够反映最新安全性和有效性的计划。改革所针对的510(k)体系,通常允许器械生产商基...
|

|
亚洲监管综述:印度限制使用进口器械
2018.03.23
本综述的重点在于印度制定分组器械申请指南,马来西亚为器械制造商制定监管途径。
印度限制公共项目使用进口医疗器械
印度制药部门(DoP)正在计划限制公共项目从外国制造商获得医疗器械的比例。DoP建议建立在去年发布的更广泛的文件上,以促进“印度制造”活动。
2017年的文...
|

|
FDA 在医疗器械网络安全方面的作用
2017.11.02
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/10/fdas-role-in-medical-device-cybersecurity/ “FDA's Role in Medical Device Cybersecurity” 2017 年 10 月 31 日,作者:Suzanne B. Schwartz, M.D., M.B.A.,FDA 医疗...
|