
|
四川一企业获 FDA OAI,提供误导性信息延误检查
2024.02.12
美国 FDA 于 2 月 9 日公布了一封签发给四川德博尔制药公司的 483 表,并且在 FDA 的检查数据库中可看到此次检查被归类为最严重的 OAI(Official Action Indicated, FDA 认为 GMP 合规严重不足,需要监管制裁,包括发警告信、进口禁令、甚至扣押上市产品等)。
FDA 检...
|

|
美国众议院持续质疑FDA海外检查不力,敦促FDA改革
2024.02.07
美国众议院能源和商业委员会(E&C)监督和调查小组委员会在 2 月 6 日的听证会上深入探讨了 FDA 的海外检查行动。两党议员都强调,由于 FDA 面临资金、人员配备以及与别国政府协调方面的挑战,有必要继续对海外检查进行改革。
美国政府问责办公室(GAO)医疗卫生小组主管 Mary Deniga...
|

|
FDA 修订远程监管评估指南扩大权限范围
2024.01.29
美国 FDA 于 1 月 26 日发布了新修订的“进行远程监管评估 — 问答”指南草案,介绍了 FDA 如何使用自愿和强制性远程监管评估来更好地了解制药商的生产情况并帮助支持审批决策。
该指南草案最初于 2022 年 7 月发布,虽然 FDA 明确表示远程监管评估(RRA)不是检查,但 F...
|

|
礼来新泽西工厂因维护和质量控制问题再陷困境
2024.01.23
根据路透社报道,礼来位于美国新泽西 Branchburg 的生产工厂再次成为 FDA 的关注焦点。这家工厂三年前曾因质量控制问题和涉嫌篡改文件而收到美国司法部的传票。
据报道,FDA 在 2023 年 7 月份对该工厂进行调查后,发现了八个新的生产缺陷,这些观察项涵盖了从跟踪生产工艺和...
|

|
FDA 披露机构改革详细计划,重新分配 1500 名监管...
2024.01.23
美国 FDA 高层官员最近介绍了其改革人用食品项目的计划,以及将监管事务办公室(ORA)转变为检查和调查办公室(Office of Inspections and Investigation)的计划。作为拟议机构改革的一部分,大约 1500 名 ORA 员工将被重新分配到产品中心,直接从事检查和调查工作。
更强 FDA (St...
|

|
【盘点】2023年10大FDA检查事件
2024.01.15
在刚刚过去的2023年,美国FDA发布多份检查类文件,包括1月发布CPGM 7356.843“批准后检查”,4月发布更新后的CPGM 7356.002“药品生产检查”,6月发布MAPP 5014.1 Rev.1“了解 CDER 基于风险的场地选择模型”,10月发布“药品生产和生物研究监测设施的远程交互式评估”等,从内...
|

|
FDA 检查发现莫德纳生产工厂存在质量控制缺陷
2023.12.20
美国 FDA 于 9 月 11 日至 21 日对麻萨诸塞州 Norwood 的莫德纳(Moderna)工厂进行了检查,发现莫德纳的主工厂存在质量控制缺陷,包括用于生产新冠疫苗原液的设备也存在控制缺陷。
该工厂用于生产莫德纳的新冠疫苗 Spikevax 以及与默沙东公司共同开发的实验室性 mRNA 癌症疫苗...
|

|
FDA就CAR-T Kymriah生产CGMP问题向诺华发布无标题信
2023.12.07
美国 FDA 于 12 月 5 日公布了一封 8 月份发给诺华的无标题信,信中概述了 FDA 检查人员在诺华新泽西 Morris Plains 工厂发现的 Kymriah(tisagenlecleucel)生产过程中与 CGMP 要求的重大偏离。
无标题信(Untitled Letter)可认为是 483 以上而警告信未满的情况下发...
|

|
稳定性研究相关缺陷、检查关注点和案例分享
2023.12.06
识林最近汇总了2013-2023财年FDA 483 年度审计缺陷列表,并发布了对2023财年483缺陷项的统计梳理。值得注意的是,在“实验室控制”一类中,有一条关于稳定性研究的缺陷项,是首次出现的全新表述。该缺陷项描述为:顺势疗法药品的稳定性评估并非基于药品上市时的同一容器密闭系统(21 CFR ...
|
|
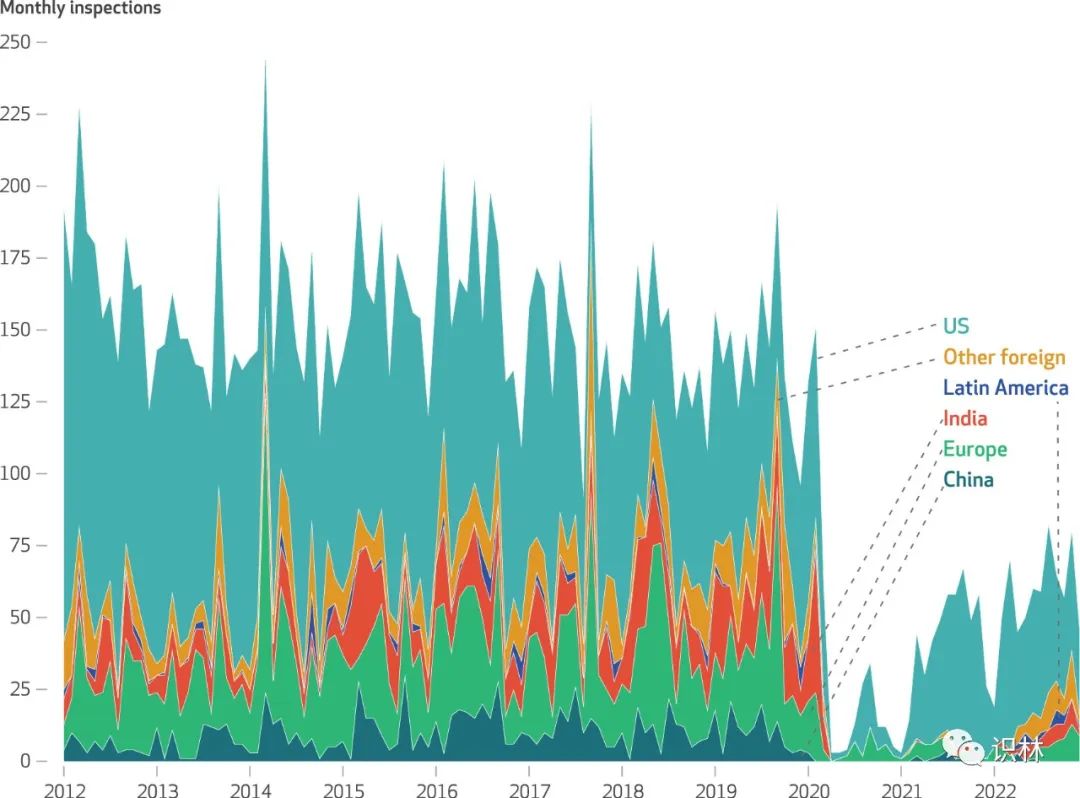
分析报告显示 FDA 对海外药品生产监管力度仍远低于...
2023.12.06
根据 12 月 4 日发表在《卫生事务》(Health Affairs)上的一篇题为“FDA 全球药品检查:对生产企业的监督仍远低于新冠(COVID-19)之前的水平”(FDA Global Drug Inspections Surveillance Of Manufacturing Establishments Remains Well Below Pre-COVID-19 Level...
|

|
FDA在2023财年发布的483缺陷项统计梳理
2023.11.30
本文从两个维度对FDA 483缺陷项进行统计梳理。一是2013-2023财年FDA 483各类别缺陷项出现频次和比例;二是对FDA在2023财年(2022年10月1日至2023年9月30日)发布的483中所涉及的所有缺陷项按照类别和出现频次进行了排序,从而帮助业界更清楚地了解FDA检查的最新关注点和GMP检查中最常出...
|

|
“药品研发质量”的定义、检查范围和实现途径
2023.11.21
2022 年 10 月,FDA 发布了修订后的CPG 7346.832 批准前检查 (PAI) 指南,本次修订在前三个目标(商业化生产的准备、与申请的符合性、数据可靠性审计)的基础上,增加了第四个目标:对药品研发质量的承诺。
新目标4:药品研发质量
目标4定义为:
通过评价药品研发计划...
|

|
FDA 监管事务办公室改组新进展,重点关注检查和调查
2023.11.20
根据行业媒体 STAT 报道,美国 FDA 正处于巩固监管事务办公室(ORA)彻底变革的最后阶段,ORA 负责监督所有受监管产品的检查和合规性。此次改革包括一个新办公室名称:检查和调查办公室(Office of Inspections and Investigations)。
新名称更直接地反映了该办公室的职责。...
|

|
FDA 发布远程药品检查指南草案
2023.10.27
美国 FDA 于 10 月 25 日发布了新的“药品生产和生物研究监测设施的远程交互式评估”指南草案,说明了 FDA 计划如何请求和对药品生产、包装、配药或贮存设施执行自愿远程检查。
这一指南草案取代了 2021 年 4 月新冠公共卫生紧急事件期间发布的类似指南草案,解释了 FDA ...
|

|
韩国三星生物工厂因数据可靠性等问题收到 FDA 483
2023.10.26
根据美国 FDA 于 10 月 17 日公布的签发给韩国三星生物(Samsung Biologics)工厂的 483 显示,五名 FDA 检查员在 8 月到 9 月间对工厂为期 10 天的检查中发现了包括数据可靠性问题在内的多项重要缺陷。
FDA 检查员在 483 表中指出,自 2013 年以来,三星生物的制造科学分析技术...
|

|
线上讲座:合规专家解读FDA近期检查趋势和飞行检查的...
2023.10.19
据识林不完全统计,今年 3 月份来,FDA 已经对中国企业进行了超过 50 次检查,除 FDA 已公布的 14 次 GMP 检查,更多是批准前检查。而已公布的 14 次检查,包括浙江燎原、杭州中美华东、桂林南药、河南东泰、浙江普洛康裕、宜昌人福、浙江仙琚、南通联亚、浙江江北、海南普利...
|

|
FDA 发布使用远程检查工具评价待审申请的指南草案
2023.09.25
美国 FDA 于 9 月 20 日发布了题为“替代工具:评价待审申请中确定的药品生产场地”的指南草案,正式确定在疫情后,继续使用替代工具来评价药品生产设施是否符合 GMP 的计划。
替代方法可以包括远程监管评价(Remote Regulatory Assessment, RRA),即对企业或其记录进行远...
|
|
CDER主任敦促制药商与FDA合作,在停产之前解决检查问...
2023.09.21
美国药品短缺已接近历史最高水平,据报道,今年第二季度,有 309 种药物处于短缺状态,成为十年来之最,并且短缺程度在过去两年中急剧上升。作为解决持续药物短缺问题的努力的一部分,美国 FDA 药品中心负责人敦促生产商在停止生产关键药物之前与 FDA 就检查问题进行合作。
9 月 1...
|

|
MHRA 概述修订后的药物警戒合规模型对检查结果的影响
2023.09.08
英国 MHRA 于 9 月 4 日发布了《药物警戒检查指标报告 2021年4月-2022年3月》,讨论了其良好药物警戒实践(GPvP)模式的变化如何影响其检查结果。
MHRA 在 2020 至 2021 财年推出了修订后的 GPvP 检查模型。该模型旨在促进选择适当的药物警戒系统、产品和非干预性研究进行检查。...
|

|
FDA检查趋势:针对OAI检查分类发出的警告信减少,FDA...
2023.08.17
近日在美国马里兰州举行的 GMP by the Sea 会议上,FDA 药品审评与研究中心(CDER)药品质量监督办公室主任 Jennifer Maguire 的演讲展示了 FDA 在执法行动方面的一些趋势。
Maguire 表示,从 2022 年 10 月到 2023 年 3 月底,FDA 共采取了 163 项执法和建议行动,...
|