
|
2015年FDA CDER新药审批总结
2016.02.06
【编者按】 年度总结不仅报告批准的新药数,还关注这些新药的品质,对增强患者医疗保健的贡献,以及用于帮助确保这些产品安全、有效研发和审批的多种监管手段和工具。
2015年FDA CDER新药审批总结
美国食品药品管理局药品审评与研究中心 (FDA CDER)
2016年1月
原文:2015 ...
|

|
I期临床试验也可能存在巨大风险—上周法国临床试验惨...
2016.01.19
1月15日,葡萄牙制药公司Bial的药品BIA 10-2474在法国的I期临床试验导致6名受试者住院治疗,其中一人已被宣布脑死亡。
法国社会事务、卫生和妇女权益部长Marisol Touraine在一份声明中表示,她的办公室上周四晚获悉关于在雷恩大学中心医院导致6人住院的“严重事故”。Touraine女士指...
|

|
2015:FDA新药批准的又一强劲年
2016.01.05
(摘自FDA Voice “2015 Another Strong Year for Patients in Need of New Drug Therapies” 2016年1月4日,作者:John Jenkins,医师,FDA药品审评与研究中心新药办公室主任)
回首2015,我很高兴向大家报告又一个FDA新药批准的强劲一年,为许多患者的严重和危及生命...
|

|
2015年美国FDA新药审批一览
2015.12.25
编者按:截止2015年12月9日,2015年美国FDA药品审评与研究中心(CDER)受理36份新分子实体申请;批准41个新分子实体,其中包括19个罕见病用药。首轮获批率创历史新高。完成PDUFA V规定的新药绩效指标。本文以图文并茂的方式,对2015年CDER新药审批情况作全景式的展现。
2015年12月14...
|

|
2015年FDA新药审评绩效
2015.12.16
FDA今日公布药品审评和研究中心(CDER)新药办公室主任John Jenkins关于2015年新药审评更新的幻灯片(PRV)获得持续关注,美国审计总署(GAO)对罕见儿科优先审评券项目的研究正在进行。NME首轮获批率保持历史性高位。美国批准的新分子实体药品继续领跑全球,2014年在美国首次推出的新活...
|

|
FDA四个月内批准Narcan喷鼻剂
2015.11.30
编者按:FDA要想快批一个药,动作真快。此次快批的原因并不是新分子或新适应症,而是新的给药方式,既方便使用又安全。不知这与FDA近来强调患者体验的重要性是否相关。此次FDA在4个月的时间内批准的Narcan喷鼻剂,为首例纳洛酮喷鼻剂版本,纳洛酮可快速停止或逆转阿片类药物过量反应,用...
|

|
屠呦呦因发现青蒿素终获诺奖
2015.10.06
瑞典卡洛琳斯卡医学院10月5日宣布,将2015年诺贝尔生理学医学奖的一半授予中国科学家屠呦呦,以表彰她“发现治疗疟疾的全新药物-青嵩素(Artemisinin)“。
在当天接受诺奖委员会的采访时,屠呦呦表示:本次获奖表明“中国团队的科研工作在抗疟疾药品研发领域处于较高水平,取得了良好...
|
|
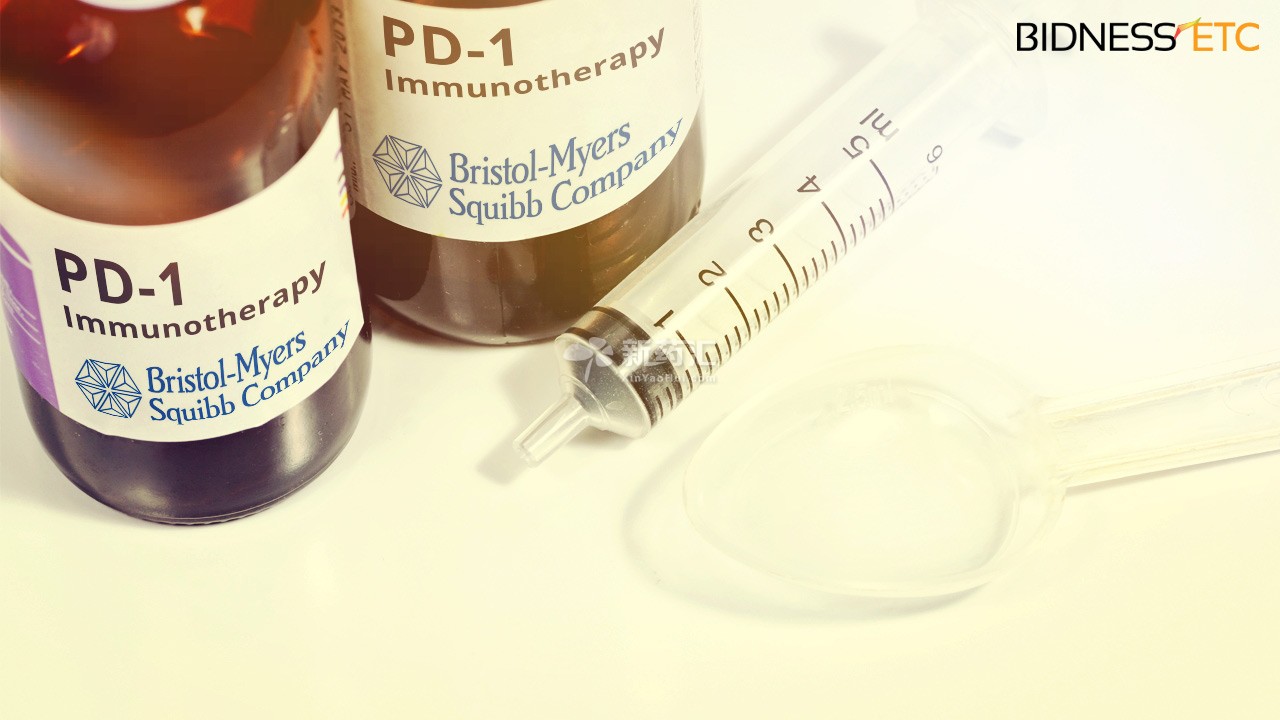
FDA最快创新药审评仅用6天
2015.03.04
FDA今日批准百时美施贵宝的Opdivo用于肺癌治疗(此前已经获得批准用于黑色素瘤),该申请上周五才被FDA接收,仅用不到一周的时间便获得了批准,比预期时间表提早3个多月。该药的治疗机理是通过阻断一种名为PD-1的途径 – 这种途径如不加控制,将允许癌细胞通过人体天然防御体系而不被发...
|

|
2014年FDA新药审评总结
2015.01.23
2014年CDER批准许多创新药
FDA药品审评与研究中心新药办公室主任John Jenkins博士
FDA Voice 2015年1月14日
每年,FDA药品审评与研究中心通常将批准100多个新治疗药物。其中一部分是之前没有被FDA批准过的新药,大多创新产品用于治疗未满足医疗需求的病症,或在其它方面显...
|

|
它山之石 - 全球6家药监机构新药审评情况
2015.01.19
2003-2014年全球6家主要药品监管机构新药审评变化情况
译自监管科学创新中心 (CIRS)《药品研发简报55》2014-12-16
校译:识林-Kapok 2015-01-19
近十年来,全球监管环境有了极大提升,主要的药品监管机构在新药审批所需时间下降。尽管如此,寻求更快获得新药的患者...
|

|
2014年CDER新药审评概况
2014.12.16
作者:识林-Kapok
2014年CDER新分子实体计划运行平稳,突破性治疗药品成为亮点。新药申请提交数保持平稳,但35个新药获批,使得2014年成为FDA新药审批的大年。新药首轮获批通过率保持高位(74%)。罕见病用药获批15个,创下《罕见病用药法案》于1983年开始实施以来的新纪录。FDA批准...
|

|
FDA2014年新药审批:为患者雪中送炭
2014.12.13
编者按:短短一页纸,突出了患者优先,讲出了药品的治疗特性,讲明了FDA的有效政策和国际优势。处处是具体数据,简洁易懂的科学讲解,对患者的关心,FDA明智监管的理念,以及FDA员工的辛勤和领导的关怀。不妨作为药监当局提高执政能力学习的范文。
FDA 2014年新药审批:为患者雪中送炭...
|

|
科学监管与对患者和家庭的同情心
2014.11.03
科学监管与对患者和家庭的同情心 — FDA关于治疗杜式肌营养不良症药物的声明
FDA通常不会对未决新药申请(NDA)做评议或和申请人公开讨论。但最近FDA公开透露了与严重和破坏性疾病—杜式肌营养不良(Duchenne Muscular Dystrophy, DMD)有关的未决NDA的一些有意思的内容。FDA的...
|

|
【IPEM】6月课程:新药发现和临床前研发—崔勇
2014.06.10
崔勇博士曾在原料药与晶型、制剂研发等多个部门负责工作,在新药开发领域有丰富的经验。崔博士于5月29日-30日首次给北大IPEM学员授课。课程从新药研发现状讲起,通过翔实的数据,介绍了常见病多发病多已得到有效控制,疑难杂症成为研发热点,单个新药适应症人群数量下降,以及II期III期临...
|

|
美国路易斯安那州法院向武田制药和礼来开出天价罚单
2014.04.08
由于武田制药和礼来制药涉嫌隐瞒畅销的糖尿病药物吡格列酮(Actos)与膀胱癌之间据称所存在的关联,美国路易斯安那州陪审团日前对这两家公司开出90亿美元的天价罚单(其中武田制药罚金60亿美元,礼来制药30亿美金)。上述罚金数额,超过阿拉斯加法院对1989年埃克森石油公司Valdez油轮泄漏...
|

|
FDA与EMA联手揭开西他列汀与利拉鲁肽安全性疑云
2014.03.03
FDA与EMA联手揭开西他列汀与利拉鲁肽安全性疑云
默克公司的Januvia(磷酸西他列汀)、诺和诺德公司的Victoza(利拉鲁肽)以及其它这类药品正受到关注。在新一轮的安全审评之后,美国与欧洲的监管机构未发现有证据显示广泛使用的肠促胰岛素类似物降糖药会引发胰腺炎或胰腺癌。
由FDA与E...
|

|
阿斯利康Brilinta的研究遭遇挑战—临床研究中心脏病发...
2014.02.11
阿斯利康Brilinta的研究遭遇挑战—临床研究中心脏病发作统计受到质疑
2014年2月2日下午744
2011年6月,FDA批准了阿斯利康公司的抗凝血药Brilinta用于冠状动脉病情严重患者。一项研究已证明该药可并挽救生命并降低心脏病发作这的确是让人感到眼前一亮的药品。
但在幕后,有关...
|

|
FDA拒绝用于多发性硬化症的开创性药品
2014.01.27
FDA拒绝用于多发性硬化症的开创性药品
— 30个发达国家批准了Lemtrada,而美国拒绝批准,彰显监管改革的必要
作者:CHRISTOPHER DEMUTH SR. And CHRISTOPHER DEMUTH JR.
2014年1月16日
阿仑单抗目前用于静脉给药治疗一种白血病。但一项历时20年、以剑桥大学...
|

|
第四届化学和药物结构分析上海研讨会
2013.04.24
第四届化学和药物结构分析上海研讨会(CPSA Shanghai 2013)将于2013年4月24-27日在上海淳大万丽酒店举行。本届会议主题是“利用转化科学、监管效率和创新模式振兴医药研发”。
CPSA会议是化学与药物结构分析领域内享有极高声誉的国际性会议,到2013年,已经连续举办十五年。CPSA上海...
|

|
CDER年度新药综述
2012.12.14
美国FDA新药评审研究中心(CDER)在2012年12月10日举行的FDA/CMS峰会上发表了2012年新药综述报告,对2011年及2012年CDER的新药评审工作做了详细的数据对比总结,主要内容包括:CDER在推进PDUFA进展中所做的工作;新药批准趋势(IND、NME、采用加速进程、罕见药等);PDUFA V/FDASIA的实...
|