
|
【周末杂谈】对企业家的称赞
2026.02.15
看看国际上是如何称赞印度药业传奇人物的 -- 叙事的着眼点和用词
一位国际友人近日分享了网上对印度药业传奇企业家赛勒斯·普纳瓦拉的称赞。这位企业家实际上是什么人不重要,重要的是大家觉得他是什么人。叙事的着眼点和用词,值得关注(请见下)。
赛勒斯·普纳瓦拉 -- 为...
|

|
【轻松一刻】我们给别人出的题是...
2026.02.14
*迎新春,又逢情人节,对家人对爱人,我们总是乐于付出。节后回到工位——我们打算出给同事的是...
工作中,人人都在出题。
给同事、领导、客户、审评员和检查官——
可我们出的是哪种题?
问答题,是轻易地托付:
问题模糊,数据零散,
法规指南没怎么看。
我们却...
|

|
GLP-1巨大利益激化冲突,诺和诺德状告配药商
2026.02.13
2月9日,诺和诺德(Novo Nordisk)向美国特拉华州联邦法院提起诉讼,指控远程医疗服务公司Hims & Hers试图销售配药(compounded)版本的司美格鲁肽(Semaglutide)药物,侵犯了其旗下降糖药诺和泰(Ozempic)及减肥药Wegovy的专利权。
此次诉讼围绕配药的销售展开,触及了药品专...
|

|
FDA 继续严控药品广告,管控药企线上会虚拟背景板
2026.02.13
FDA在2025年底与2026年初连续向百济神州(BeOne Medicines)发出两封无标题信(untitled letter),就其两款产品的推广材料提出违规指控。这些行动涉及该公司用于视频会议的虚拟背景图像以及一则电视广告。
背景板可以做广告,但一样要合规
2025年12月15日的无标题信指出,该公...
|
|
GDUFA IV 聚焦五议题:仿制药“美国优先”和费用博...
2026.02.12
FDA近日公开了2026年1月7日召开第四轮仿制药用户付费法案(GDUFA IV)谈判的会议纪要,结合此前公布的2025年12月17日谈判会议纪要,可以看到各方围绕仿制药申请(ANDA)项目费用结构、设施费用豁免、境外检查费调整及本土生产优先审评试点计划等议题展开讨论。
尽管目前各方尚未达成...
|

|
不用再“猜”处方,美仿制药 Q1 Q2 正式立法
2026.02.12
2月3日,旨在加速特定仿制药审批的“Q1/Q2”法案已作为《2026财年拨款法案》的一部分正式立法。该立法核心是建立机制,向仿制药生产商提供关于原研产品的定性和定量(Q1/Q2)处方信息,从而进一步简化开发和审评审批流程。
此次立法源于仿制药行业长期面临的一项关键监管障碍。根据F...
|

|
欧洲药典12.3发布新通则《5.38 数据质量》
2026.02.11
欧洲药典(Ph. Eur.)于12.3版发布了《5.38 数据质量》(Quality of Data)新通则,聚焦如何确保数据质量,以增强对数据驱动应用、模型及其预测结果可靠性的信心。对于依赖多源、大数据量的机器学习(ML)和人工智能(AI)而言,这一点尤为关键。
通则5.38为整个数据生命周...
|

|
EMA 拟修订 GMP 附录15“确认和验证”强制用于 AP...
2026.02.11
2月9日,EMA发布概念性文件启动对《GMP附录15:确认和验证》(Qualification and Validation)的修订程序。本次修订的核心目标是将附录15的适用范围从目前的“可选补充指南”转变为对活性物质(Active Substance, AS)生产商的强制性要求,并整合ICH《Q9(R1) 质量风险管理》的最...
|
|
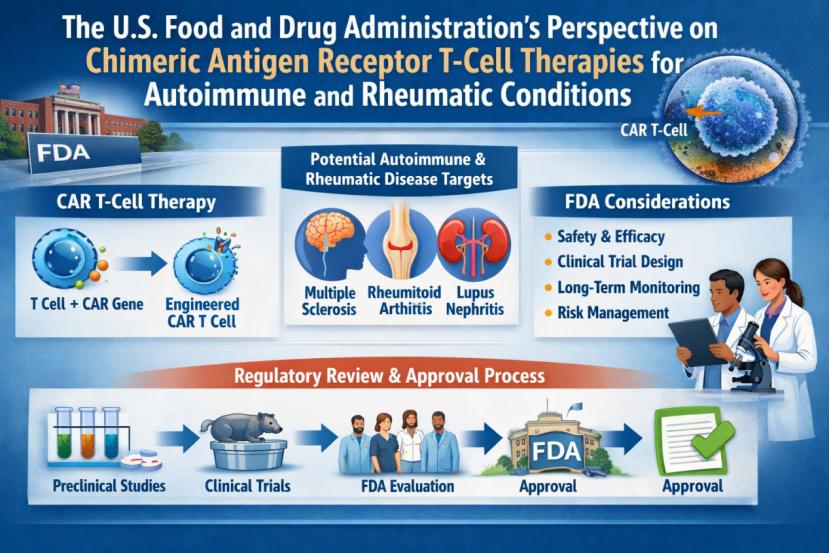
CBER 主任发文强调自免疾病 CAR-T 疗法的长期安全...
2026.02.10
2月3日,FDA生物制品审评与研究中心(CBER)主任Vinay Prasad与其同僚Anam Tariq、Vijay Kumar共同发表文章《FDA对自身免疫性和风湿性疾病嵌合抗原受体T细胞治疗的观点》,系统阐述了CAR-T细胞疗法在自身免疫及风湿性疾病中的监管思路。
FDA认可该疗法在系统性红斑狼疮(SLE)、...
|
|
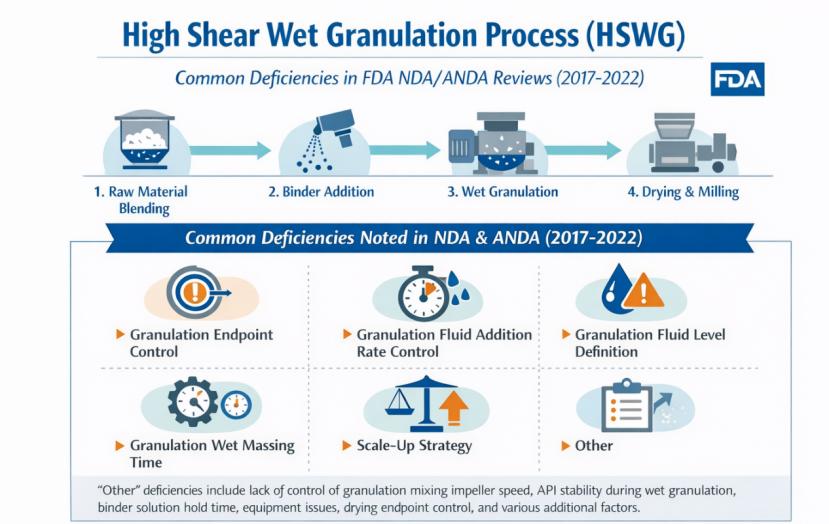
FDA 分享高剪切湿法制粒5大常见审评缺陷
2026.02.10
FDA药品审评与研究中心(CDER)研究人员于1月23日发表回顾性分析文章《近期提交的新药及简化新药申请中观察到的高剪切湿法制粒工艺常见缺陷》,对2017年至2022年间提交的NDA与ANDA中涉及高剪切湿法制粒(High Shear Wet Granulation,HSWG)的生产工艺缺陷进行了回顾性分析。
该研究...
|

|
国际药政每周概要:EMA 定稿非致突变杂质评估,FDA ...
2026.02.10
【非临床与临床研究】
2.3,【SFDA】疫苗的临床考虑
2.5,【PMDA】关于肥厚型心肌病药物开发的考虑(早期考虑)
【药学研究】
2.2,【EMA】关于非致突变杂质的界定的思考性文件
【生产质量】
本周 483和警告信
【经营准入】
2.6,【FDA】拟对未经其批准的 G...
|
|
WHO 分享271个疫苗 cGMP 问答合集
2026.02.09
近日,WHO公开了2024年cGMP线上培训马拉松(Virtual Training Marathon)的详细问答合集文件,总计收录了271个技术问题及专家的解答。
该培训由盖茨基金会与欧盟委员会资助,自2020年开始每年举办。此轮培训于2024年9月10日至10月10日举行,课程内容基于WHO的无菌GMP(与EU和PIC/S...
|

|
IPEM 课程 2026无菌保证系列:第一、二课
2026.02.09
无菌保证系列:第一、二课
授课老师:尹放东、苏虹
上课日期:3月7-10日(周六 - 二)
授课方式:中文
上课教室:上海
2026年无菌保证系列共四课8天,本次第一、二课共4天,将系统梳理无菌产品历史起源,无菌保证的理论基础、核心理念和法规要求;解析污染控制策略 (...
|

|
国内药政每周导读:CDE 定稿抑郁障碍、神经病理性疼...
2026.02.09
【非临床和临床研究】
2.4,【CDE】关于发布《神经病理性疼痛治疗药物临床试验技术指导原则(试行)》的通告(2026年第9号)
2.4,【CDE】关于发布《慢性失眠治疗药物临床试验技术指导原则(试行)》的通告(2026年第1号)
2.6,【CDE】关于发布《化学仿制药透皮和局部给...
|

|
【周末杂谈】从贝叶斯统计,想监管创新
2026.02.08
用了多年的I、II和III期分段式临床研究监管方式,可以变变吗?
新年伊始,为鼓励创新,中美欧三方分别发布了鼓励使用贝叶斯方法的指导性文件。 尤其让人高兴的是美国和欧盟药监部门的指导性文件是征求意见稿,我国药监局发的已经是定稿指导原则了,征求意见稿是去年8月发的。全球领先,...
|

|
【识林社区】近期提问:临床申报和样品,出口证明和原...
2026.02.07
识林社区是面向所有识林用户的互动交流平台。在这里,识林用户提出问题,同时也解答问题,并参与讨论。大家期待的答案,不是一句道听途说,也不仅是“经验之谈”,而且越重要越复杂的问题,往往并无拿来即用的答案。
好的答案,应兼具“依据”、“思考”和“建议”。读者不仅可以有...
|
|
FDA 请求药企自愿撤市 Tavneos 遭拒绝
2026.02.06
近日,FDA正式要求安进(Amgen)自愿将其用于治疗抗中性粒细胞胞浆抗体相关性血管炎(ANCA-associated vasculitis, AAV)的药物Tavneos(avacopan,阿伐可泮)撤出市场。安进公司拒绝了这一请求。接下来双方可能就该药物的未来展开长达数月的交涉。
安进公司于2022年以37亿美元收购Che...
|

|
口溶膜新药被 FDA 拒批,仅因包装“人因工程”安全...
2026.02.06
2月2日,FDA针对Aquestive Therapeutics公司的过敏贴剂Anaphylm发出了一封完全回应函(CRL),理由是该药物的包装存在问题。Anaphylm是一种置于口腔内的小型薄膜(oral film),可在溶解时释放肾上腺素。
目前这份CRL尚未公开。该公司新闻稿称,FDA主要针对Anaphylm人因工程学验证研究...
|

|
三方共建药典各论:FDA、USP 与 AAM 会商药典新战...
2026.02.05
link=13px 【FDA】质量与监管可预测性:塑造USP标准 2025.12
2025年12月11日,FDA、美国可及药品协会(AAM)与美国药典委员会(USP)联合举办题为"质量与监管可预测性:塑造USP标准"(Quality and Regulatory Predictability Shaping USP Standards)的网络研讨会...
|

|
美国药典 2026 Issue4 内容更新概要
2026.02.05
美国药典(USP)于1月30日发布 2026 Issue4内容,同时释出评论文件详细披露了公众意见反馈及专家委员会(Expert Committee,EC)裁决结果。本文将简要梳理并分类列出2026 Issue4中通则和各论。
评论&回应
异丙醇及其共沸物各论的修订
评论者建议将"杂质—挥发性杂质限度"...
|