
|
FDA 服从法院裁决,将造影剂等药物转为器械监管
2021.08.11
美国 FDA 于 8 月 9 日向利益相关者和公众发布通告,表示将很快开始执行一项法院裁决,该裁决可能要求 FDA 将一些作为药物批准的产品转变为作为器械进行监管。
今年 4 月,FDA 在美国哥伦比亚特区巡回上诉法院的一场官司中败诉,因为 FDA 辩称自己作为监管机构,由于“药...
|

|
业界要求 FDA 进一步澄清 ICH Q12 的既定条件、...
2021.08.10
美国 FDA 于今年 5 月发布《ICH Q12:FDA 监管产品的实施考量》指南草案向利益相关者征求反馈意见【FDA 发布 ICH Q12 实施考量指南,详述如何实施既定条件并提供示例 2021/05/16】,反馈截止日期为 7 月 19日,FDA 收到了包括来自制药行业贸易协会以及单独企业的https//www.regulat...
|

|
FDA 发布小分子近红外分析方法指南,生物制品相关指...
2021.08.10
美国 FDA 于 8 月 6 日发布了《近红外分析方法的开发和提交》定稿指南,帮助制药商了解如何使用基于近红外(NIR)的分析方法来评估药物属性。
指南定稿了 2015 年发布的指南草案,并对其进行了更新,以更好地反映自该草案发布多年以来 NIR 的使用情况,并纳入了 NIR 技术的...
|
|
美国三大机构开展公私合作提高基因治疗产品病毒载体质...
2021.08.09
美国药典(USP)、美国国家标准与技术研究所(NIST)和国家生物制药创新研究所(NIIMBL)于 7 月 27 日宣布了一项新的公私合作项目,以评估分析方法并制定腺相关病毒(AAV)的标准。AAV 已经成为一种日益重要的基因治疗载体。
根据 NIIMBL 的公告,AAV 对基因治疗特别有用,因为 ...
|

|
【一周回顾】2021.08.02-08.08
2021.08.09
药审中心发布低分子量肝素仿制药免疫原性研究指南,抗肿瘤药首次人体试验扩展队列研究指南。美国 FDA 发布近红外分析方法的开发和提交指南,公布两封警告信。欧盟更新植物药问答。识林新增多篇文献及总结资料。
上周热点资讯:
不卖给我参照药品?将你告上法庭
欧盟发布药品研发...
|

|
【质量对话】阻碍仿制药上市的高院决定
2021.08.08
美国政府的败诉,新药和仿药企业都高兴,但百姓遭殃
编辑:7月30日,美国政府联邦贸易委员会(FTC)被迫撤回了对新药公司艾伯维的起诉。官司的实质是艾伯维非法串通仿药公司Teva和Perrigo,延迟首仿药上市,让艾伯维年销售10亿美元的男性激素药昂斯妥凝胶(AndroGel)继续享受无竞争的...
|

|
欧盟孤儿药和儿科用药法规修订拟议遭业界反对
2021.08.07
欧盟委员会关于改革欧盟儿童和罕见病药物立法的最新磋商引发了利益相关者的一些尖锐回应。以研发为基础的欧洲制药业再次 拒绝了减少孤儿药和儿科药物开发激励、促进更快的仿制药和生物类似药竞争以及引入“未竟需求(unmet needs)”的法律定义的提议。
根据欧盟委员会的说法,虽然欧...
|

|
美国联邦机构将审查 FDA 对阿尔茨海默新药 Aduhelm...
2021.08.06
美国卫生部(HHS)监察长办公室(OIG)于 8 月 4 日宣布将对 FDA 有关渤健(Biogen)的阿尔茨海默药 Aduhelm(aducanumab)的加速审批程序进行广泛审查。
OIG 的此次审查似乎不仅针对 Aduhelm 的审批,而是针对更广泛的整个加速审批计划,但 Aduhelm 是被专门点名的唯一药物。...
|

|
美国头号仿制药企关闭后续:工厂获关键基础设施指定
2021.08.06
我们在上期的周末杂谈中报道了美国第一大仿制药企 Viatris(前 Mylan)公司关闭其在美国西弗吉尼亚州的工厂,解雇 1400 名雇员,详见:【周末杂谈】美国头号仿制药企关闭在美工厂。在不到一周后,事情有了一些变化。
西弗吉尼亚州众议院议员 Barbara Evans Fleischauer 本周二...
|

|
FDA 警告信:从进口禁令上的供应商处采购原料药
2021.08.05
美国 FDA 于 8 月 3 日公布的一封针对 Syntec Pharma 公司的警告信给出了一个明确信号,即,企业有可能因将处于进口禁令上的工厂所生产的制剂及其原料药(API)进口到美国而收到警告信。
这封警告信于 7 月 6 日发给位于纽约州的 Syntec Pharma 公司,基于 2020 年 10...
|

|
未能报告临床试验结果:FDA 发出第二封不合规罚款通...
2021.08.04
美国 FDA 于 7 月 26 日向位于乔治亚州的一家小型制药公司 Accuitis 发出了不合规通知,称其未能按照联邦法规的要求在联邦注册机构提交临床试验的结果。
这是 FDA 发出的第二封此类信函,2007 年《FDA 修订法案》(FDAAA)第 801 节提出了有关联邦研究的报告要求。临床试...
|
|
不卖给我参照药品?将你告上法庭
2021.08.04
全球第一大仿制药企 Teva 药业最近将一家品牌药企业告上了法庭,原因是该企业没有卖给其开发仿制药所需的足够的参照药品。Teva 不仅要求法庭裁决命令品牌药企出售参照药品,还要求对这家企业处以相应的惩罚。
7 月 13 日 Teva 在美国宾夕法尼亚东区联邦地区法院起诉 Amicus Therap...
|
|
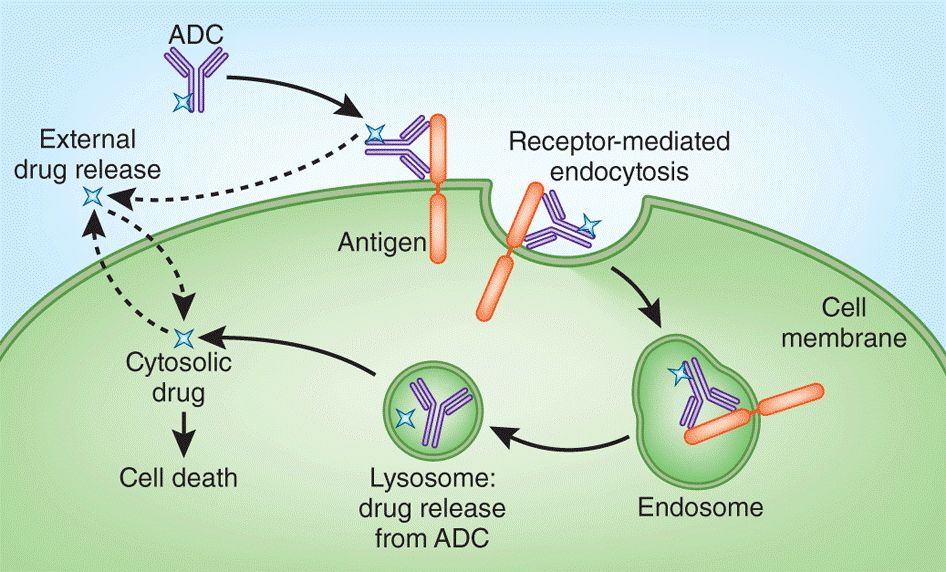
【转载】FDA 对 ADC 药物非临床安全性的审评考量
2021.08.03
近十年来,随着抗体偶联药物(Antibody-Drug Conjugate,ADC)技术的不断完善,ADC上市新药的数量逐渐增加。截至2021年5月,FDA已经批准了11个ADC新药。此外,在超过350个在研项目中,超过60个ADC正处于美国临床II期和III期研究阶段。
由于ADC药物设计的复杂性和多样性,需要考虑抗...
|

|
欧盟发布药品研发中质量属性可比性评估的统计方法学文...
2021.08.03
2021年7月27日,欧洲药品管理局(EMA)发布《药品研发中关于质量属性可比性评估的统计方法学的思考性文件》 (以下简称“思考性文件”)。同时发布的还有一份对思考性文件修改意见的采纳说明。
思考性文件提供了当前有关统计方面的监管考虑,以便在生产前后变更、生物类似药研发和仿制...
|

|
【一周回顾】2021.07.26-08.01
2021.08.02
ICH 发布广受期待的 Q13 原料药与制剂的连续制造指南。欧盟更新 GMP 和 MAH 思考性文件,发布药物研发中关于质量属性可比性评估的统计方法学的思考性文件,药械组合产品质量文件指南,以及关于含有基因修饰细胞的先进疗法药品的核心产品特征总结、标签和包装说明书的指南草案。美国...
|

|
阿尔茨海默病药物最新研究结果被批夸大其词、无法解释
2021.08.02
独立研究人员对来自 Cassava 科学公司的阿尔茨海默病实验性治疗药物所宣称的获益表示怀疑。
Cassava 科学公司于 7 月 29 日在阿尔茨海默病协会国际会议(AAIC-2021)上表示,对一项小型临床试验的初步分析表明,其名为 simufilam 的药物改善了阿尔茨海默病患者的认知能力,这...
|

|
【周末杂谈】美国头号仿制药企关闭在美工厂
2021.08.01
企业公然违背制造业回迁和缩短供应链的国策,但政府沉默和媒体低调
一个月前,白宫刚刚发布由商务部、能源部、国防部和卫生部准备的、题为“筑造稳固供应链,振兴美国制造业,促进全面增长”的长达250页纸的报告【美国政府百日供应链审查报告中涉及药品和原料药的重点有哪些?2021/06/...
|

|
欧盟更新 MAH 和 GMP 法规体系思考性文件
2021.07.31
欧洲药品管理局(EMA)于 7 月 27 日发布了 GMP 和 MAH 思考性文件“Reflection paper on Good Manufacturing Practice and Marketing Authorisation Holders”,规定了根据欧盟委员会(EC)GMP 指南和其它欧盟立法,上市许可持有人(MAH)负有的 GMP 责任,系统梳理了欧...
|

|
FDA 面临国会重重压力,国外检查重启在即?
2021.07.30
美国 FDA 于本月早些时候在美国重新开始了检查, 让 FDA 有机会解决在疫情期间积压的大量国内检查。但是国外检查呢?去年 3 月至 10 月,FDA 仅执行了 3 次国外检查。美国国会议员希望知道 FDA 何时可以恢复正常的检查行动,尤其是在海外的检查行动。
美国众议院能源与...
|

|
FDA 公布 2022 财年仿制药和生物类似药收费费率
2021.07.30
美国 FDA 于 7 月 27 日在《联邦公报》上分别公布了仿制药使用者付费项目(GDUFA)和生物类似药使用者付费项目(BsUFA) 2022 财年(2021 年 10 月 1 日至 2022 年 9 月 30 日)的费率。下面我们分别来看看。
GDUFA
GDUFA 的费率整体有所上涨,但幅度不大。最大的增...
|