
|
欧盟发布针对新冠病毒变体的疫苗开发指南
2021.03.01
欧洲药品管理局(EMA)近日发布了一份思考性指南文件列出了支持预防新冠病毒(SARS-CoV-2)变体的疫苗许可所需的数据和要求。EMA 在宣布新指南的新闻稿中表示,“为疫苗的适应性制定快速监管程序,以保护公众免受当前或未来变体的侵害是当务之急。”
在此之前 2 月 10 日,国际...
|

|
【一周回顾】2021.02.22-02.28
2021.03.01
国药中生武汉公司、康希诺新冠疫苗分别获国家局附条件批准,强生下属杨森公司新冠疫苗获美国 FDA 紧急使用授权。药审中心发布审评报告公开工作规范,就基因修饰细胞治疗产品非临床研究与评价征求意见。美国和欧盟分别发布有关新冠病毒变体的开发和监管考虑指南。美国 FDA 分别发布针...
|

|
【周末杂谈】从新冠疫苗的研制看产品创新
2021.02.28
研制新产品可从了解其新功效、时效和用法等方面着眼
这周四,国家药监局条件批准了康希诺的腺病毒新冠疫苗。这周五,美国FDA开专家会讨论强生的腺病毒新冠疫苗紧急授权,专家们一致赞同授权【杨森新冠疫苗专家会意见,22-0 全票支持紧急使用授权】。这两款疫苗的临床试验规模都是多国...
|

|
【快讯】杨森新冠疫苗专家会意见,22-0 全票支持紧...
2021.02.27
北京时间 2 月 27 日早 6 点 10 分,美国 FDA 就杨森(Janssen)新冠疫苗Ad26.COV2.S的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天对杨森新冠疫苗的广泛讨论后,外部专家全票(22赞成,0 反对)通过,认为基于可用全部科学证据,杨森的新冠疫苗在 18 岁及以...
|

|
FDA 关于杨森新冠疫苗紧急使用授权的专家会资料
2021.02.27
美国 FDA 于 2 月 26 日就杨森(Janssen)新冠疫苗 Ad26.COV2.S 的紧急使用授权(EUA)召开专家会。在结束了一整天对杨森新冠疫苗的广泛讨论后,外部专家全票(22赞成,0 反对)通过,认为基于可用全部科学证据,杨森的新冠疫苗在 18 岁及以上个人中使用的获益超过其风险。有...
|

|
美国总统签署行政令审查和加强美国药品供应链
2021.02.26
美国总统拜登于 2 月 24 日签署一项行政令,要求联邦机构以协商一致、包容各方的方式研究和加强药品与其它关键技术领域的供应链。
新冠(COVID-19)全球大流行使许多政策制定者对加强美国供应链产生了紧迫感,为解决这一问题,美国前特朗普政府曾发布行政令要求联邦机构购买在美国...
|
|
辉瑞新冠疫苗真实世界证据显示百分之九十四保护效力
2021.02.26
首个针对辉瑞/BioNTech 新冠疫苗经过独立审查的真实世界研究显示,该疫苗在预防新冠(COVID-19)方面非常有效。
到目前为止,有关新冠疫苗保护效力的大多数数据都是在临床试验受控条件下生成的,因此,如何将结果转化到具有不可预测变量的真实世界中尚存在不确定因素。在以色列开展...
|
|
FDA 延长亚硝胺风险评估期限,欧盟给出评估后分情形...
2021.02.25
美国 FDA 今日宣布修订了其 2020 年 9 月发布的《人用药中亚硝胺杂质的控制》指南【FDA 发布人用药中亚硝胺杂质的控制指南 2020/09/02】,将指南中建议的制药商对原料药和制剂中亚硝胺风险评估的截止日期延长一个月至 2021 年 3 月 31 日,与欧盟的要求协调一致,这也是很多...
|

|
杨森新冠疫苗专家会会前资料,对病毒变体的效果比预期...
2021.02.25
美国 FDA 于 2 月 24 日发布了针对杨森生物技术(Janssen Biotech)公司单针新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为疫苗是有效的,并可预防新冠疾病导致的住院。
杨森还公布了新数据,显示该疫苗...
|

|
瑞德西韦新药批准 CMC 审评分析,18 项上市后稳定...
2021.02.24
从美国 FDA 公布的审评卷宗看,在吉利德(Gilead)公司生成有关 Veklury(瑞德西韦)关键原料药和成品制剂批放行和稳定性数据之前,FDA 就批准了该药用于新冠(COVID-19)治疗。
这可能让业界看到一线新机遇:针对其它病症的重要治疗产品有可能在得到所有数据并提交到 FDA 之...
|

|
制药业的数字化变革:数字技术、虚拟检查以及云申报
2021.02.24
新冠疫情改变了人们的日常生活和工作方式,也驱使制药企业不得不思考数字化转型的问题。Genentech 生物产品开发 CMC 法规部门负责人 Benedicte Lebreton 在最近召开的 CASSS WCBP 新冠(COVID-19)对生产运营的影响研讨会上表示,大流行带来的旅行限制加快了 Genentech 对头戴...
|
|
如何加快复杂仿制药批准?业界提出改进建议
2021.02.23
2 月 9 日由美国媒体 The Hill 主办、普享药协会(AAM)赞助的“复杂仿制药和处方药格局”网络研讨会上,业界传达了非常重要的信息,尤其是目前针对仿制药使用者付费修正案 III(GDUFA III)的谈判正在试图加快仿制药办公室(OGD)对复杂仿制药的审批程序。
美国企业研究所常驻研究员 ...
|

|
FDA 发布一系列疫苗、诊断试剂和治疗指南应对新冠病...
2021.02.23
美国 FDA 于 2 月 22 日发布了一系列四篇指南以应对已出现以及未来可能出现的新冠(COVID-19)病毒变体,指南分别涉及疫苗、诊断试剂和治疗产品。
FDA 代理局长 Janet Woodcock 表示,“FDA 致力于寻找有效的方法来改良正在开发管线中的或已获紧急使用授权的医疗产品,以...
|

|
【一周回顾】2021.02.15-02.21
2021.02.22
药审中心发布生物类似药相似性评价和适应症外推技术指导原则。WHO 发布首个从纸质到数字化途径的 SMART 指南,推出新工具帮助各国建立儿童癌症计划。欧盟发布应对新冠病毒变体的计划。识林发布 FDA 药品质量办公室 2020 年度报告全文翻译。FDA 发布针对上海中华药业南通公司和印度 Shi...
|
|
协调表征细胞因子释放综合征促进 CAR-T 细胞疗法的...
2021.02.22
根据美国癌症研究之友最新发表的一份白皮书1,表征细胞因子释放综合征(CRS)将是确保免疫肿瘤学领域更广泛的接受先进细胞和基因疗法的关键。细胞因子释放综合征通常出现在新型免疫疗法中,例如,T 细胞抗体桥和 CAR-T 细胞。
美国 FDA 生物制品审评和研究中心(CBER)负责人 Peter ...
|

|
【周末杂谈】科学诚信与监管科学
2021.02.21
看FDA是如何提供促进和保护监管科学和科学家发展的制度环境
这周四《识林》报道了一家消费者公众组织质疑FDA在审评Biogen公司的阿尔茨海默药时的职业操守,以及FDA代理局长Janet Woodcock医学博士对此的回复【FDA 回复对阿尔茨海默药审评程序的批评,拒绝在申报前和申报后人员之间建...
|

|
瑞士药品管理局新指南详述抗癌药多国同步审批 Orbis...
2021.02.20
瑞士药品管理局(Swissmedic)已决定https//www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/swissmedic-beteiligt-permanent-projekt-orbis.html 长久参与 Orbis 计划(Project Orbis),这是一项全球计划,允许参与机构同时审评新的癌症药物。Swissmedic 最近...
|
|
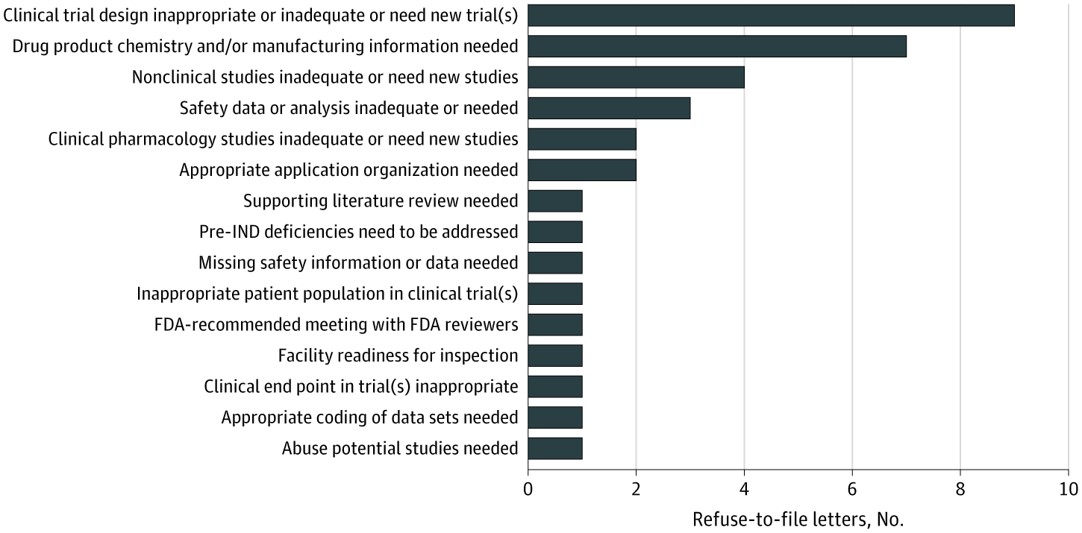
FDA 立卷审查拒收原因和公开披露情况分析
2021.02.19
日前发表在《美国医学会杂志》内科医学研究上的一项研究1发现,美国 FDA 通常会针对“实质性”缺陷发出立卷审查拒收(refuse-to-,RTF)函,这些缺陷包括缺少产品质量、安全性和有效性所需的信息。
这项研究的主要作者是 FDA 局长办公室公共卫生策略和分析人员 Harinder Singh Ch...
|

|
欧盟宣布应对新冠病毒变体的新计划
2021.02.19
欧盟于 2 月 17 日宣布了一项应对新冠(COVID-19)病毒变体的计划:将建立一个新的称为“HERA 孵化器“的生物防御准备计划,与欧盟和全球研究者、生物技术公司、制药商和公共机构合作,检测和评估新变体,为开发新型和调整疫苗提供激励措施,加快这些疫苗的批准程序,并确保扩大生产能...
|

|
FDA 回复对阿尔茨海默药审评程序的批评,拒绝在申报...
2021.02.18
美国 FDA 长期以来在可批准的申请方面一直采取协作方式与制药商合作,以将新药推向市场。但当一个药充满争议时,监管者和企业之间的这种关系就容易受到指责。
12 月,消费者倡导组织公共公民(Public Citizen)就 FDA 对 Biogen(渤健)有争议的阿尔茨海默药 aducanumab 上市...
|