
|
辉瑞因亚硝胺杂质在美国召回降压药 Accuretic
2022.03.23
继本月初辉瑞公司在加拿大召回两种降压药 Inderal-LA(盐酸普萘洛尔)和 Accuretic(盐酸喹那普利和氢氯噻嗪片)之后,同样由于致癌性亚硝胺杂质的存在,辉瑞于本周一宣布在美国自愿召回 Accuretic 品牌药和其全资子公司 Greenstone 分销的两种仿制降压药。
所有召回,包括去年...
|

|
《中药材生产质量管理规范》花脸稿(2022-2018)
2022.03.22
3月17日,国家药监局、农业农村部、国家林草局、国家中医药局等四部门发布《中药材生产质量管理规范》的公告,进一步从根本上推进中药材规范化生产,加强中药材质量控制,促进中药高质量发展。本规范共十四章,第一百四十四条,自发布之日起施行。与原国家药品监管局2002年发布的试行版...
|

|
国际药政每周概要:2022.03.14-03.20
2022.03.22
03.15 【FDA】指南草案 包含人类基因组编辑的人类基因治疗产品
FDA 就研究性新药(IND)申请中应包含的信息提出了建议。FDA 建议产品申办人使用最适合其基因组目标和预期修饰类型的设计平台。IND 应包括对设计和筛选过程的描述以及方法的基本原理。FDA 还建议 IND 包括基因组...
|

|
FDA 用户付费法案再授权,国会想“顺便”立法,业界...
2022.03.21
UFA,User Fee Act或者Amendment,即用户付费法案,或称申请人付费法案。其本质上是一份“收钱办事”的协议(deal),首先各路利益相关方游说国会立法者,之后国会授权FDA收取费用,同时FDA向国会和相关方承诺工作目标,由此形成一种审评审批制度的动态调整机制。
目前的UFA有14种之多...
|

|
国内药政每周导读:2022.03.14-03.20
2022.03.21
【监管综合】
3.18,NMPA发布《药品监督管理统计报告2021年第三季度》
3.18,中检院发布《国家药品抽检年报2021》
【临床研究】
3.14,CDE发布《化学药品改良型新药临床试验技术指导原则问与答》第1版(征求意见稿)
【CMC】
3.14,药典委发布《中国药典》2020年...
|

|
【周末杂谈】新冠病毒与神话、愿望及科学
2022.03.20
读英国《自然杂志》评论,看如何科学地认知新冠病毒的变异、传播和致病
疫苗的普及,使新冠病毒的传播越来越难。
疫苗的普及,使新冠患者的症状越来越轻,将使新冠病毒成为“良性”病毒。
新冠病毒之所以越传越弱,是因为把受体都弄死了,自己也就活不下去了,所以要与受体共存。
...
|

|
FDA 和 EMA 平行科学建议计划进展更新
2022.03.19
美国 FDA 和欧洲药品管理局(EMA)于 2022 年 3 月 16 日召开网络研讨会,讨论了 FDA 和 EMA 平行科学建议(PSA)计划如何为申办人药物研发中的复杂科学问题制定解决方案,从而节省申办人的时间和资源。
PSA 计划于 2017 年启动,于 2021 年 9 月扩大到包括对复杂仿...
|

|
【识林主题词】新增:先进疗法,核酸药物,脂质纳米颗...
2022.03.18
什么是识林主题词?
— 主题词是识林产出的知识,源于对大量法规、文献、案例、问答的综合分析,并从概述/概述、法规指南、实施指导、视频、问答、案例、参考资料等多维度呈现。
— 区别于散点化的法规和技术资料,主题词是精炼沉淀的知识,目的是帮助识林用户系统学习,全面了...
|

|
RNAi 治疗药公司 Alnylam 起诉辉瑞和 Moderna 新...
2022.03.18
RNA 干扰(RNAi)治疗药巨头 Alnylam 制药于 2022 年 3 月 17 日宣布,正在就使用 Alnylam 的可生物降解脂质向辉瑞和 Moderna 提起诉讼并寻求赔偿,该成分对于两公司的新冠 mRNA 疫苗都是不可或缺的。
Alnylam 在向联邦特拉华州地区法院提起的诉讼中要求,对其技术的使...
|

|
FDA 发布 CAR-T 细胞治疗的研发考量指南草案
2022.03.17
美国 FDA 于 2022 年 3 月 15 日发布了令人期待已久的《嵌合抗原受体(CAR)T 细胞治疗的研发考量》指南草案,旨在帮助申办人开发 CAR-T 细胞产品。
该指南的发布自 2020 年起就一直列在 FDA 生物制品审评与研究中心(CBER)的指南计划清单上,但拖到今年才正式出炉...
|

|
美国会提出新法案帮助仿制药申请人解决定性定量(Q1Q2...
2022.03.17
对于许多药品而言,出于建立与原研药或参照上市药品(RLD)产品配方相同的目的确定定性(Q1)和定量(Q2)配方(辅料种类和用量与参照药品相同)有时是一件极具挑战的工作。如果Q1/Q2做好了,那么就有可能豁免某些药品(例如,眼科制剂、非胃肠道制剂,甚至一些局部和固体口服制剂)的体...
|

|
识林公开课:中药质量问题解析与药品安全风险防控
2022.03.16
中医药创新传承一直备受关注,今年政府工作报告更是提出“支持中医药振兴发展,推进中医药综合改革”的发展目标。同时,近期也有多项政策法规涉及中药智能化制造的应用,中药材追溯体系的建立,中药新药的研发与审评、中药上市后评价和药物警戒,从而实现中药全过程质量控制。但中药生产 G...
|

|
【识林会议日历】20220316-0331 预告
2022.03.16
识林会议日历
会议是医药产业学习的关键途径之一。会议数量太多,质量参差不齐,没有实时更新提醒的平台,经常会错过一个好会、或在一个不好的会耽误时间,并无处吐槽。
识林会议日历,专门搜集国内外有专业声誉和影响力的会议日程,梳理详细信息和原始链接,并提供评分和评价功能...
|

|
国际药政每周概要:2022.03.07-03.13
2022.03.15
03.07 【FDA】预测和提高抗致病菌疫苗疗效的方法
开发保护性疫苗的主要障碍之一是我们对有助于在肺等黏膜表面产生有效免疫反应的机制理解不完全。此外,尚不清楚这些免疫反应如何受到组织内常驻共生细菌(微生物群)的影响。研究计划的目的是确定表明疫苗对细菌病原体有效的免疫反应...
|
|
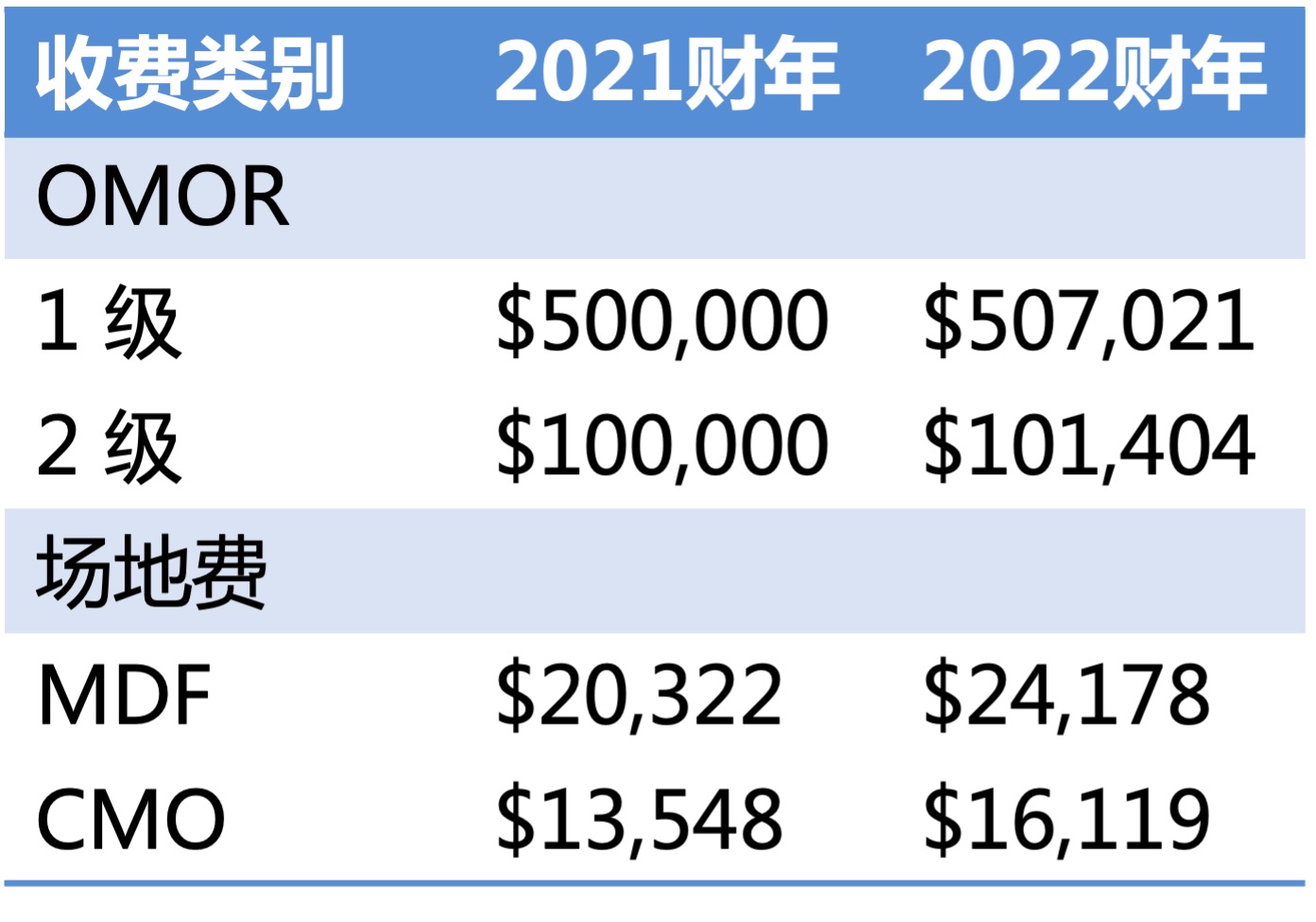
FDA 公布 2022 财年非处方药专论费率,场地费增加...
2022.03.15
美国 FDA 于 2022 年 3 月 14 日公布了其非处方药(OTC)专论使用者付费法案(OMUFA)2022 财年的费率,包括 OTC 生产场地、合同生产组织(CMO)以及 OTC 专论令申请(OMOR)费用(两级)。2022 财年的 OTC 专论药场地费将于 2022 年 6 月 1 日到期。下表显示了 2021 ...
|

|
国内药政每周导读:2022.03.07-03.13
2022.03.14
【政策导向】
3.7,2022“两会”一些具体明确的制药业提案
【研发与注册】
3.11,CDE发布《药物临床试验期间方案变更技术指导原则》(征求意见稿)
3.11,CDE发布《已发布化学仿制药参比制剂调整程序》(征求意见稿)
3.10,NMPA发布《仿制药参比制剂目录 (第五十...
|

|
FDA 2022 财年综合拨款法案增加 1.02 亿美元,国...
2022.03.14
美国国会两院立法者于 2022 年 3 月 9 日公布了 1.5 万亿美元的 2022 财年综合拨款法案文本。法案为 FDA 要求了 33 亿美元的可自由支配资金,比 2021 财年实际拨款水平增加了 1.02 亿美元。
美国 2022 财年的年度支出计划法案的发布已经多次推迟,立法者不得不通过...
|

|
【质量对话】令人失望的 FDA 质量量度计划
2022.03.13
制药行业生产科学的状态需要改进,过度监管阻碍了创新
编辑:这周二,FDA公告了其在“质量量度计划”方面的最新思考并征求业界的意见。知道您一直关注质量量度,所以想听听您对此有何想法。
刺槐:FDA作为药品科学监管火车头,……
编辑:这话听上去怎么不对味呀,有话您就直说吧...
|

|
FDA 可见异物指南专题 — 检查与评价
2022.03.12
2021年12月14日,FDA官网发布《注射剂产品中可见异物的检查》的行业指南草案,识林联合IPEM邀请盛德律所的合规和监管专家Christopher Fanelli和Daniel Roberts先生于2022年1月27日解读了该指南(会议回放视频请登录识林查看),并在2022年3月1日邀请IPEM项目的两位资深教师 — 礼来苏...
|

|
美国四大联邦机构筛选 8 个研究项目,合力研究延长 ...
2022.03.11
美国国家航空航天局、美国国立卫生研究院(NIH)卫生与人类服务部生物医学高级研究与发展局(BARDA)以及美国 FDA 近日宣布在一份多机构合作中授予了 8 份合同,这些合同将使用自动化工程功能在复杂的人体体外模型(例如组织芯片或微生理系统)中进行实时在线读数,以期将组织活力和生...
|