|
美国科学院发布 COVID-19 疫苗优先接种建议草案
2020.09.02
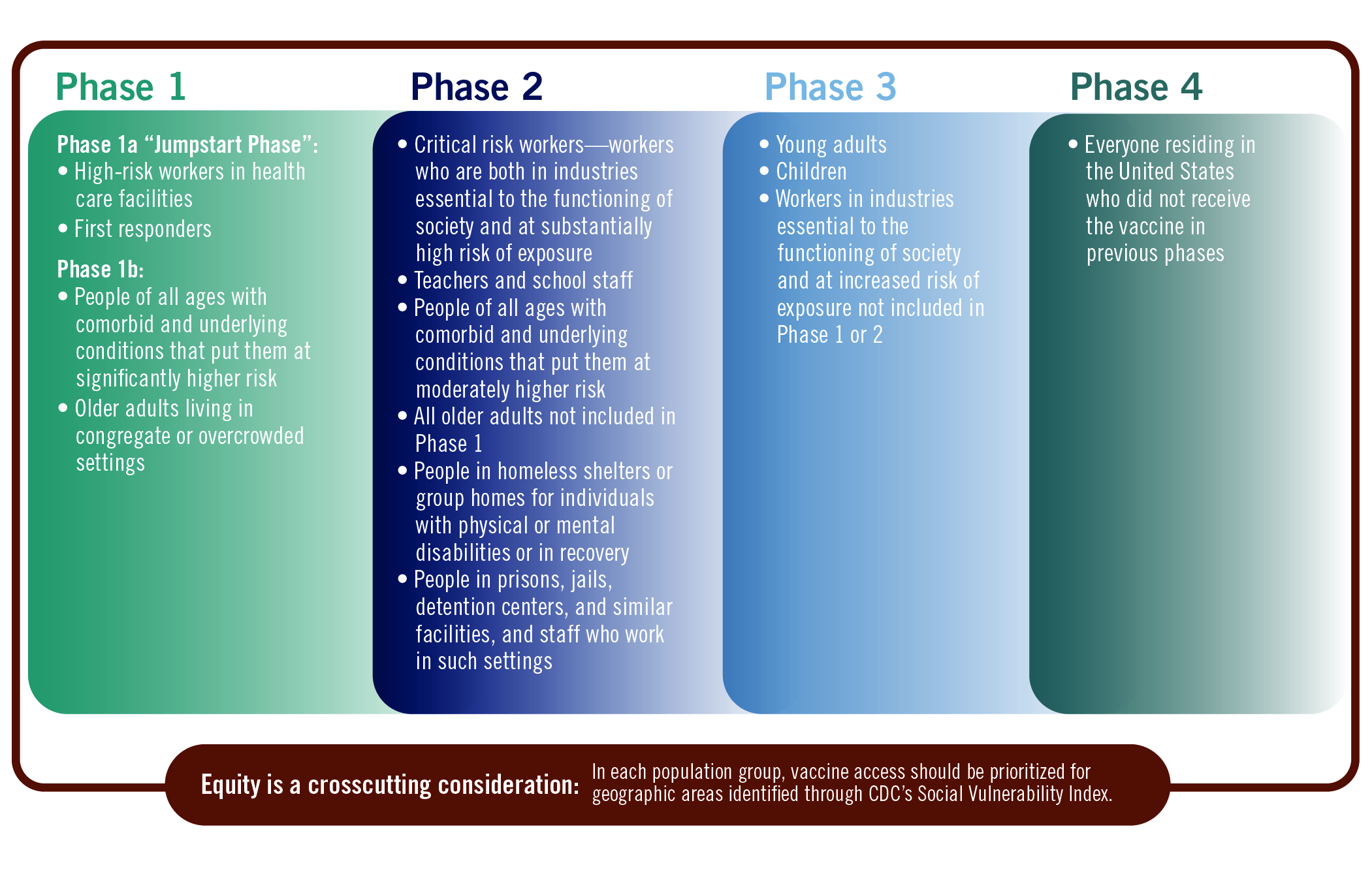
9 月 1 日,美国国家科学、工程和医学研究院发布了一份讨论哪些群体应优先接种 COVID-19 疫苗的报告草案,对于接种人群的优先级给出了详细建议。
报告题目为“公平分配 COVID-19 疫苗的初步框架讨论草案”,长达 114 页,由国家卫生研究院院长 Francis Collins 和美国疾控中心(C...
|

|
FDA 发布人用药中亚硝胺杂质的控制指南
2020.09.02
美国 FDA 于 9 月 1 日发布题为《人用药中亚硝胺杂质的控制》的立即生效指南,介绍了可能引入亚硝胺杂质的条件,建议了原料药和成品制剂生产商为检测和防止药品中亚硝胺杂质含量超出可接受水平而应采取的步骤。
在某些类型的药品中发现亚硝胺导致 FDA 和其他国际监管机构对受影响...
|

|
FDA 获益-风险框架在新药批准中的作用
2020.09.01
获益-风险框架提供了交流重要决策因素的灵活机制,支持FDA药品批准决策的多样化。
背景
FDA批准一个药品上市,首先评价其是否有效,然后评价获益是否大于风险。FDA跨学科审评小组通过评估大量科学及临床数据来作出监管决策。在作出监管决策时,现有证据难免不完善,因此需要科学的监...
|

|
法律专家对 FDA 疫情期间检查指南的解读与预测
2020.09.01
法律专家认为美国 FDA 新发布的疫情期间药品检查问答指南为行业留下了一些余地,可以提出新的方法来评估 GMP 合规符合性而无需进行现场检查。法律专家认为,可灵活发挥的程度将取决于 FDA 如何执行该指南,以及是否会发布更多指南。
FDA 于 8 月 19 日发布《COVID-19 公共...
|

|
【一周回顾】2020.08.24-08.30
2020.08.31
WHO 发布共线生产清洁验证残留限度指南修订草案以及监管决策中良好信任实践指南修订草案。FDA 新发布和修订一批具体产品生物等效性指南;紧急使用授权康复期血浆用于新冠治疗;对达托霉素体外药敏试验敏感度折点修订做出决定并说明理由。ICH 发布E14/S7B QT/QTc间期延长和潜在心律...
|

|
欧盟无菌附录修订草案中 PUPSIT 要求仍遭到业界反对
2020.08.31
欧盟无菌 GMP 附录(Annex 1)第二轮征求意见期已于 7 月 20 日结束,此次意见征求可能是对于欧盟无菌附录重大修订最终敲定之前的最后反对机会,业界再次对于要求过滤器测试策略的提议表示担忧,认为该策略可能导致其本想防止的严重污染。
虽然非肠道药协会(PDA)承认,总体而言...
|

|
识林药品数据库上线啦!
2020.08.31
同步更新全球新药审评报告
截至2020年8月20日,识林药品数据库收录了近3万个CDER批准的人用药(包括生物制品)和EMA集中审评批准/拒绝的人用药的10万余份审评和支持资料,并每周更新,经本地化处理,访问速度快。
数据库包括产品的规格、剂型、市场状态、审评资料、说明书等各类信息...
|

|
【周末杂谈】FDA 饱受诟病的一周
2020.08.30
当FDA的科学和独立性受质疑时,受损的不仅是FDA,更是百姓和医药产业
5个月前,识林“看FDA局长是如何捍卫FDA专业尊严的”一文报道了FDA科学和独立性一面。3月19日,任职不足百天的FDA哈恩局长,当着总统的面,在媒体发布会上,反复纠正总统欠专业、欠妥的说法,用守法、科学、专业又易...
|

|
FDA 发布 19 篇新 BE 指南和 17 篇修订指南
2020.08.29
美国 FDA 于 8 月 28 日发布了 36 篇具体产品生物等效性(BE)指南,为开发仿制药提供建议,提供支持简化新药申请(ANDA)批准所需的证据,从而有助于简化企业的仿制药开发和 FDA 的 ANDA 评价。到目前为止,FDA 共发布 1938 篇具体产品指南,今年已经发布了近 150 篇。...
|

|
FDA 通告抗结核药中亚硝胺超标,目前不打算采取强制...
2020.08.28
美国 FDA 于 8 月 26 日发布通告解释对两种抗结核药利福平和利福喷丁中亚硝胺杂质超标的处理方式。
利福平和利福喷丁均是用于治疗结核病的抗生素,并且利福平还用于治疗其它严重的细菌感染。在这两种药品样品中均发现亚硝胺的含量升高:1-甲基-4-亚硝基哌嗪(MNP)被发现在利福平中...
|

|
ANDA 合并与所有权转移均可能影响下一年仿制药缴费
2020.08.28
美国 FDA 仿制药办公室(OGD)于 8 月 26 日发布政策和程序手册《MAPP 5242.1 所有权转移》,介绍了 OGD 的橙皮书工作人员将如何处理由药品申请的前所有者和现所有者提交的转移申请所有权。
橙皮书是 FDA 发布的提供已批准的所有处方药的清单,包括对多家来源药品的治疗等...
|

|
WHO 发布共线生产清洁验证残留限度指南草案修订稿
2020.08.27
WHO 于 8 月 23 日发布《在共线生产时为识别污染风险而在清洁验证中建立残留限度的不同方法(包括 HBEL)的考量要点》指南草案第一版修订稿。指南提供了在清洁验证中考虑依据药理和毒理学数据的基于健康的暴露限(HBEL)时应考虑的基于风险和科学的方法的要点,还提供了审查多产品设...
|

|
FDA 删除糖尿病药卡格列净的腿脚截肢风险黑框警告
2020.08.27
美国 FDA 于 8 月 26 日宣布删除强生公司的糖尿病治疗药卡格列净(canagliflozin)处方信息中有关截肢风险的黑框警告,涉及的产品包括 Invokana(卡格列净)以及基于卡格列净的复方产品 Invokamet(卡格列净/盐酸二甲双胍)和 Invokamet XR(卡格列净/缓释盐酸二甲双胍)。FDA...
|

|
FDA 新冠康复期血浆紧急使用授权的证据是否支持结论...
2020.08.26
美国 FDA 于 8 月 23 日许可了新冠(COVID-19)康复期血浆的紧急使用授权(EUA),引发了业内的广泛批评。尤其是 EUA 的发布时间非常敏感,就在特朗普总统公开指责 FDA 为阻止他竞选连任而在 COVID-19 疫苗和治疗产品方面行动缓慢。人们担心 FDA 的决策可能受到政治压力和...
|

|
FDA 因技术问题推迟对药品产量数据的收集
2020.08.26
美国 FDA 于 8 月 24 日宣布,将不会按《冠状病毒援助、救济和经济安全法案》(CARES 法案)的要求下个月开始收集药品产量数据。
CARES 法案第 3112 条为药品生产商制定了新的报告要求,旨在改善对药品短缺的响应,包括将救命药物的短缺报告要求扩大到包括“在公共卫生紧急情...
|

|
USP 使用标准品销售数据构建供应链风险模型预测药品...
2020.08.25
美国药典会(USP)正在建立一种风险模型,以帮助利益相关者评估药品供应链中如果不加以防治可能会导致药品短缺的漏洞。该模型基于对 USP 参照标准品的需求程度和地域分布,于今年早些时候启动,以应对 COVID-19 大流行期间的药品短缺问题。
USP 供应链分析高级总监 Vimala Raghaven...
|

|
FDA 发表在美销售的难制处方药的质量研究分析
2020.08.25
医护人员和患者对美国处方药的质量缺乏客观了解,公众广泛质疑美国处方药供应的整体质量,尤其是仿制药和国外供应的产品的质量。根据一项调查显示, 74% 的医护人员不知道或不确定他们是否相信在美国境外生产并在美国合法销售的药品是否遵守 FDA 要求的严格生产标准和规定。为回应这...
|

|
美国总统公开指责 FDA 并限制其对新冠检测的监管
2020.08.24
【编者按】FDA 一直自视为独立的科学监管机构,尽管卫生部是其名义上司。史上只有一次 FDA 的决定被卫生部推翻,那就是 9 年前的避孕药事件。这次总统公开指责 FDA 为阻止他竞选连任,而拖延审批新冠病毒检测产品,卫生部又明令限制FDA对检测的监管。事态的发展,值得注意。
...
|

|
【一周回顾】2020.08.17-08.23
2020.08.24
识林推出中美欧孤儿药注册申请对比,欧盟质量授权人概述。药审中心发布流感抗病毒药物临床试验技术指导等多篇技术指导。FDA 发布减少生物利用度和生物等效性留样数量的合规政策指南,以及 COVID-19 期间检查问答指南。欧洲药品质量管理局(EDQM)发布对 CEP 持有人的亚硝胺风险评...
|

|
【周末杂谈】合理监管 — 为企业减负
2020.08.23
从BE-BA合规政策指南看FDA如何为企业,尤其是小企业减负
这周二,FDA发布了《依据 21 CFR 320.38(c) 保留的生物利用度(BA)和生物等效性(BE)样品数量的合规政策 – 工业界指南》【FDA 发布BA和BE留样合规指南,为企业减轻留样负担 2020/08/19】。名称虽长,但意思明确,...
|