
|
ICH 质量指南修订计划:杂质、病毒安全性、风险管理...
2020.08.22
ICH 质量讨论组建议对 ICH 质量指南进行六项增补和修订,其中 ICH 管理委员会已经接受其中的四项修订工作,包括:病毒安全性评价、质量风险管理、可萃取物和可浸出物评估,以及通用技术文件质量综述。
讨论组报告员、辉瑞公司副总裁兼全球 CMC 负责人 Roger Nosal 于 8 月 ...
|

|
FDA 发布指南详述疫情期间现场检查策略
2020.08.21
美国 FDA 于 8 月 19 日发布《COVID-19 公共卫生紧急事件期间生产、供应链、药品和生物制品检查问答》即时生效指南,提供了与检查、待决药品申请和已批准药品生产设施变更相关的法规和政策常见问题解答。
FDA 在指南中确认,在 FDA 对申办人在其产品上市申请中列出的生产设...
|
|
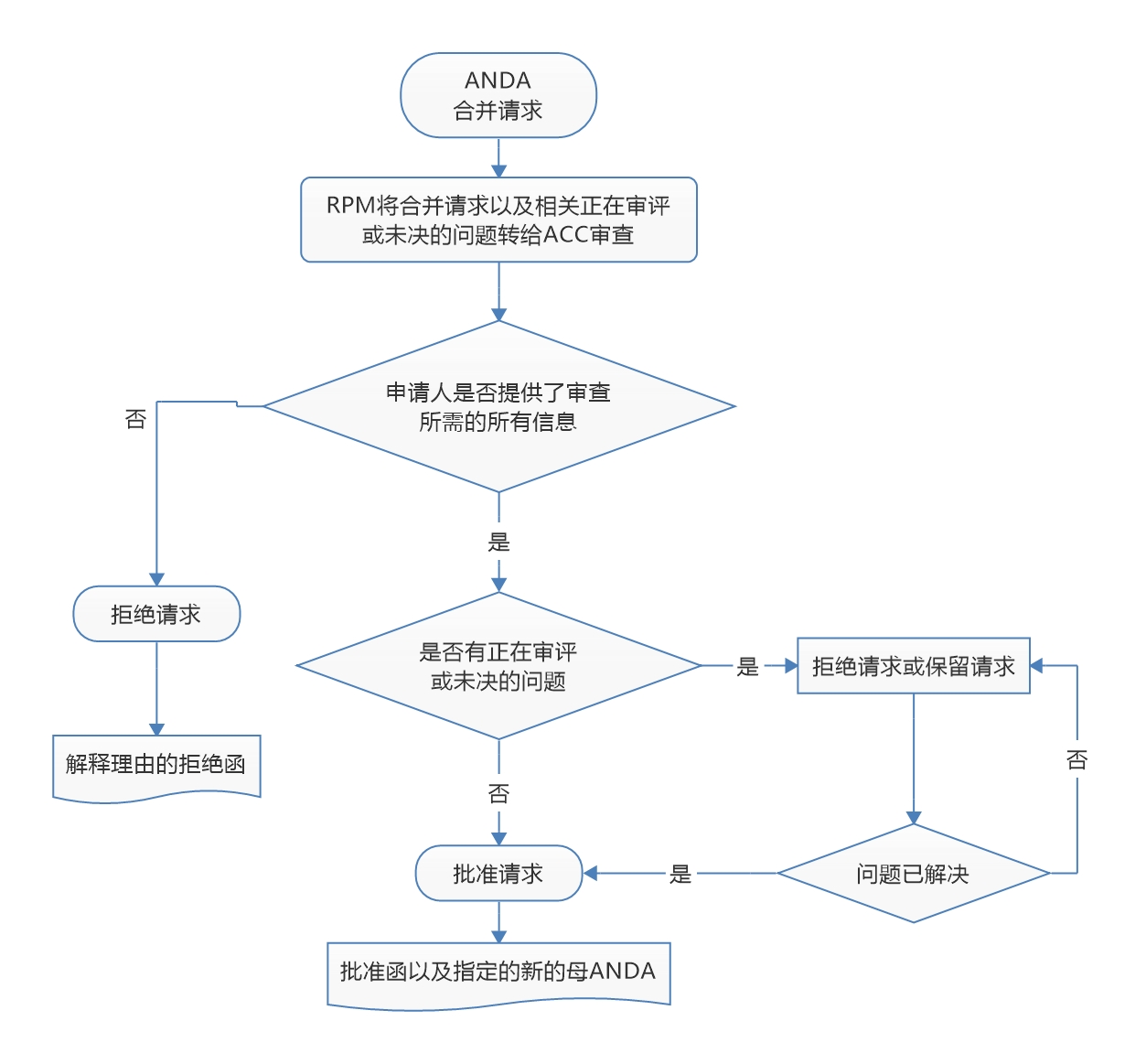
FDA 发布同一产品不同规格 ANDA 号合并的修订程序...
2020.08.21
美国 FDA 仿制药办公室(OGD)于 8 月 19 日发布了修订政策与程序手册(MAPP 5241.2 Rev.1)《仿制药办公室的ANDA合并》,介绍了相同厂家、同一药品、不同规格的多个 ANDA 申请号合并为一个 ANDA 申请号的政策和程序。
该手册的最初版本于 2015 年 10 月发布,此次发...
|

|
MHRA 回顾共线生产中交叉污染控制的常见问题
2020.08.20
英国药品与医疗保健产品监管机构(MHRA)近日发布官方https//mhrainspectorate.blog.gov.uk/2020/08/18/cross-contamination-control-in-shared-facilities-and-equipment-reflection-on-common-deficiencies-and-expectations-as-seen-in-recent-pic-s-guidan...
|

|
德国新数据收集法规开始实施,上市后证据生成将影响定...
2020.08.20
德国药品定价和报销机构德国联邦联合委员会(G-BA)首次利用新法律授权要求公司为其产品提供上市后证据。诺华/Avexis 公司的脊髓性肌萎缩症(SMA)基因治疗药 Zolgensma 成为首个在新法下提供上市后证据的产品,公司将必须收集有关不同的 SMA 治疗方法如何起效的数据。
各公司已...
|
|
FDA 新发布急性髓细胞白血病治疗药开发指南草案
2020.08.19
美国 FDA 于 8 月 17 日发布了《急性髓细胞白血病:开发用于治疗的药品和生物制品》新指南草案,协助申办人对治疗急性髓细胞白血病(AML)的药品和生物制品进行临床开发。指南草案涉及 FDA 对于支持 AML 治疗适应症(包括仅限于单独治疗阶段的适应症,例如,维持、移植准备方案...
|

|
FDA 发布BA和BE留样合规指南,为企业减轻留样负担
2020.08.19
美国 FDA 于 8 月 18 日公布了题为《依据 21 CFR 320.38(c) 保留的生物利用度和生物等效性样品数量的合规政策》立即生效指南。该合规政策指南与保留体内生物利用度(BA)和体内或体外生物等效性(BE)研究中使用的测试产品和参照标准品的留样有关,不再要求留样可以足够执行 ...
|

|
FDA 定稿指南明确对未能公开临床数据的企业罚款
2020.08.18
美国 FDA 发布了《有关 ClinicalTrials.gov 数据库的民事处罚》定稿指南。指南解决了 FDA 各中心应如何应对违反联邦法规要求,未能准确、完整地登记注册临床试验并在 Clinicaltrials.gov 网站上报告结果的责任方的问题。FDA 各中心包括药品中心、生物制品中心和器械中心。
FD...
|

|
【一周回顾】2020.08.10-08.16
2020.08.17
上周药审中心发布关于新冠疫苗研发、非临床和临床研究相关的五份重磅指南;发布生物类似药相似性评价和适应症外推指南草案;FDA 发布上市状态通知定稿指南,临床试验数据库的民事罚款指南。欧盟发布对罕见疾病和儿科用药立法的评估报告。WHO 发布监管机构良好监管规范。识林CAR-T 细...
|

|
品牌药行业希望 FDA 提供更多会议沟通机会
2020.08.17
为更加高效和有效地与美国 FDA 沟通,行业代表希望在处方药使用者付费计划(PDUFA)重新谈判中加入更多会议指标。但 FDA 对目前的会议负担似乎已经勉力而为,去年就错过了几个与会议沟通相关的 PDUFA 目标。
生物技术创新组织新兴公司执行副总裁 Cartier Esham 在 PDUFA VI...
|

|
【周末杂谈】触家规就是犯国法吗?
2020.08.16
了解美国是如何将药品法与GMP规章和企业内部操作绑在一起的
没按SOP做,就是违法吗?
SOP是企业的家规,与《药品法》有何关系?
与罚款更多的《虚假宣称法》又有何关系?
简单的答案是,关系直接且密切。
先来看看美国历史上两件最大的因GMP违规,而受到法庭处罚的案例。
第一个...
|
|
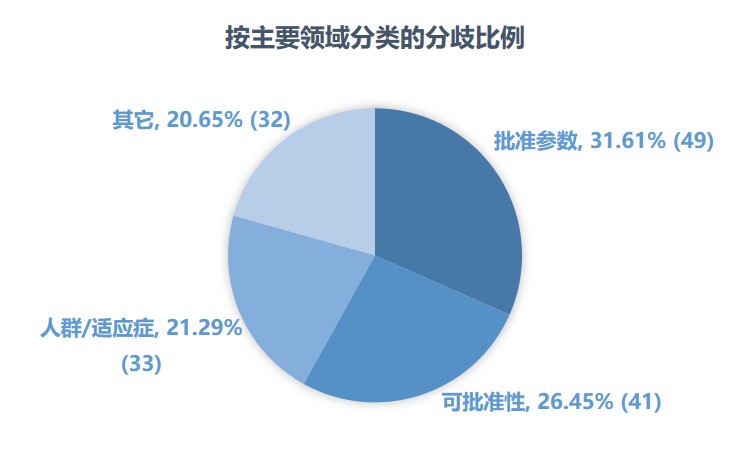
FDA 新药批准近四分之一存在内部审评意见分歧
2020.08.15
自美国 FDA 于去年夏天宣布以综合审评文件取代基于学科的审评文件包以来,研究人员和利益相关者们就一直持反对意见,担心能看到的公开信息会随之减少,一些有价值的信息将无法轻易获得,其中 FDA 内部审评意见的分歧就是最有价值的信息之一。研究人员最近发表的一项分析就反映了这方面...
|

|
欧盟发布对孤儿药和儿科用药法规的全面评估报告
2020.08.14
欧盟委员会于 8 月 11 日发布了其对于罕见疾病和儿科用药立法的评估报告,这是欧盟《孤儿药法规》和《儿科用药法规》分别于 2000 年和 2006 年颁布以来的首次全面评估。评估报告显示,尽管这两项法规促进了新药的开发和供应,但并未成功将投资引导至最需要的领域。报告正文长达 10...
|

|
FDA 供应链安全试点:错误率更低更高效的射频识别标...
2020.08.14
美国 FDA 最近的一项供应链安全试点显示,在药品供应链中,除条形码外,还需要使用射频识别(RFID)标签,可以减少识别错误,提供更有效的方式来确保供应链的完整性并防止药品造假。
Sandoz 的母公司诺华美洲区域序列化负责人 David Mason 在 7 月 31 日的《药品供应链安全法案》...
|
|
FDA 发布针对治疗性蛋白质的药物相互作用指南草案
2020.08.13
美国 FDA 于 8 月 7 日发布新指南草案《治疗性蛋白质的药物与药物相互作用评估》,通过提供一种系统的、基于风险的方法,帮助研究用新药申请(IND)的申办人、生物制品许可申请(BLA)的申请人确定对于治疗性蛋白质进行药物-药物相互作用(DDI)研究的需求。
指南草案由药品审评与...
|

|
美国国家研究所牵头研究 COVID-19 疫苗制造问题
2020.08.13
美国国家生物制药制造创新研究所(NIIMBL)于 7 月 28 日举办网络研讨会,会上目前新冠(COVID-19)疫苗研发的几大主要参与者探讨了疫苗制造技术问题以及 NIIMBL 可以帮助解决的方面。
为保护人们免受 COVID-19 感染,疫苗制造商将重点放在尽快生产疫苗上,但是针对速度的优...
|

|
FDA 新药与仿制药上市状态通知要求指南定稿
2020.08.12
美国 FDA 于 8 月 10 日发布有关新药和仿制药的上市状态通知定稿指南 — 《根据 FDCA 506I 的上市状态通知;内容与格式》,明确了其对于申请持有人在产品撤市或产品获批后无法销售时提交上市状态通知的监管期望。
根据《2017 FDA 重授权法案》(FDARA),要求制药商在药品...
|
|
FDA 局长和主任联合发文增强公众对新冠疫苗的信心
2020.08.12
为打消公众对于新冠(COVID-19)疫苗的担忧,增强疫苗的信心,美国 FDA 局长、副局长和生物制品中心主任联合撰文,向公众解释和保证对 COVID-19 疫苗的严格监管。
FDA 局长 Stephen Hahn 医学博士、生物制品审评与研究中心(CBER)主任 Peter Marks 医学博士和 FDA 副局长 Ana...
|

|
制药商对于从美国工厂购买基本药物的行政令反应如何?
2020.08.11
美国总统特朗普于 8 月 6 日签署“购买美国产品(Buy American)”的行政令,指示联邦政府更多地依赖美国本土制药工厂采购基本药物。【美国总统行政令要求仅能从美国工厂购买基本药物 2020/08/07】虽然行政令的许多细节尚不清楚,但仍受到全球制药商的批评。
COVID-19 大流行...
|

|
瑞德西韦:向 FDA 提交新药申请,与辉瑞合作扩大生...
2020.08.11
吉利德(Gilead)公司的瑞德西韦(remdesivir)是至今为止唯一一个获得监管部门批准用于治疗 COVID-19 患者的药品。瑞德西韦已在欧盟、日本、澳大利亚和英国获得有效条件上市许可,在美国获得紧急使用授权(EUA)。吉利德于https//www.gilead.com/news-and-press/press-room/press-re...
|