
|
【一周回顾】2020.08.03-08.09
2020.08.10
上周中美关系仍是制药界关注焦点之一,美国总统颁布行政令要求联邦政府从美国工厂购买基本药物,并且开始招标储备关键原料药。识林推出基因毒性杂质专题,以及有关使用 QSAR 软件预测化合物的致突变性的案例解析。CDE 发布多篇技术指南,包括化药注射剂灭菌和无菌工艺研究及验证、群...
|

|
欧盟发布亚硝胺杂质问答指南,给出杂质评估、检测和缓...
2020.08.10
欧洲药品管理局(EMA)于 8 月 6 日发布更新后的问答指南文件为上市许可持有人(MAH)提供了有关亚硝胺杂质处理的建议。指南给含化学合成 API 的 MAH 更多时间用来评估产品中是否存在有潜在致癌性的亚硝胺杂质,还为含生物药 API 的制剂的 MAH 执行类似的评估设定了新的截止日期...
|

|
【质量对话】糊里糊涂地谈质量?
2020.08.09
药品质量是常见的话题和用词,但几乎找不到其明确的定义。
编辑:《质量对话》这个专栏,已经做了几次了,但好像还从没有明确过我们所说的“质量”是什么意思,具体讲就是在这个专栏里,我们是如何理解“药品质量”?
刺槐:我查了《药品管理法》、《药品注册管理办法》和《药品生产...
|
|
FDA 发布 2019 财年上市后要求和承诺年报
2020.08.08
美国 FDA 在其近日发布的关于制药商执行上市后要求(postmarketing requirement, PMR)和上市后承诺(postmarketing commitments, PMC)的绩效年报
中表示,大多数上市后研究正在按期进行。
上市后要求是申请人被要求执行的批准后研究或临床试验,上市后承诺是申请人书面同意...
|
|
FDA 批准首款脊髓性肌萎缩症(SMA)口服治疗药
2020.08.08
美国 FDA 于 8 月 7 日宣布批准了首款治疗脊髓性肌萎缩症(SMA)的口服治疗药 — Evrysdi(risdiplam),为目前依赖昂贵注射治疗产品的患者提供了新选择。SMA 是一种罕见且通常致命的遗传疾病,影响肌肉力量和身体运动,可导致瘫痪、呼吸困难和死亡,是婴儿死亡的主要遗传原因。
...
|

|
FDA 质量基准研究向全球召集参与企业
2020.08.07
企业匿名参与,研究结束后可获得一份只有自己能够看到的定制报告
美国FDA一直都在寻找如何能继续推进和落实质量量度计划,而且试图从业界和学术界的试点和研究中获得更多知识,以期找到可行之路。
奖励质量(或者可以说“优质优价”),是 FDA 一直想做的事,2013 年FDA 就提出单靠...
|

|
美国总统行政令要求仅能从美国工厂购买基本药物
2020.08.07
美国总统特朗普于两个小时前宣布https//www.whitehouse.gov/presidential-actions/executive-order-ensuring-essential-medicines-medical-countermeasures-critical-inputs-made-united-states/ 签署了一项行政令,指示联邦政府仅能从美国工厂购买基本药品和其他医疗...
|

|
FDA 大力宣传先进制造以解决疫情凸显的制造和供应链...
2020.08.06
美国 FDA 局长 Stephan Hahn 以及医疗和科学事务副局长 Anand Shah 在 8 月 3 日 FDA 博客文章中表示,可以采用先进制造技术来解决美国在 COVID-19 大流行期间遇到的一些制造和供应链问题。文章提到当前对制药业回迁美国的广泛关注,强调仅重视问题并不足以将供应链回迁...
|
|
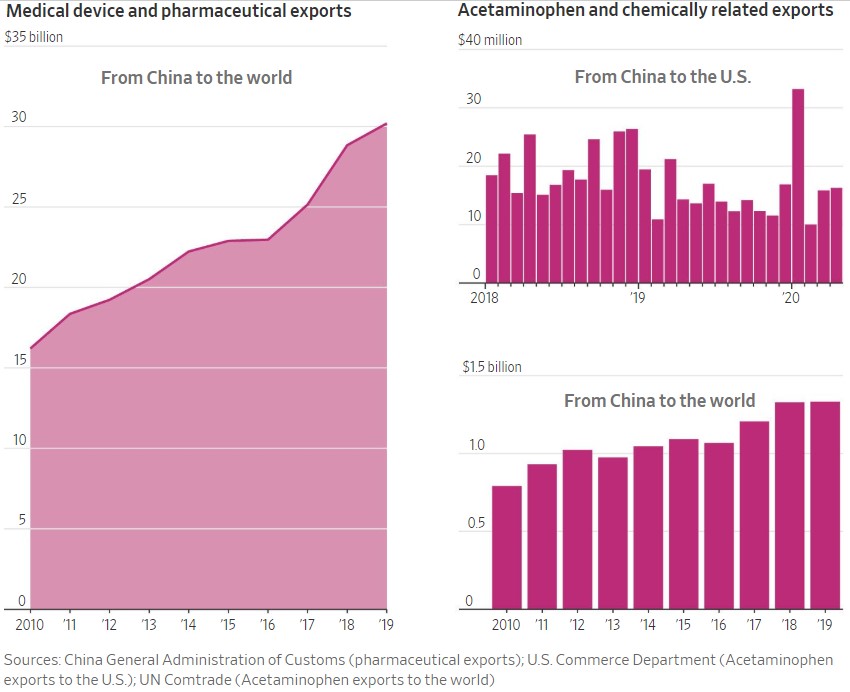
全球药品供应链大势:从对乙酰氨基酚说起
2020.08.06
美国《华尔街日报》今日刊发的一篇文章从一种最简单的非处方止痛药对乙酰氨基酚入手,试图描绘当前全球药品供应链对中国的依赖程度,以及中国原料药生产的优势和原料药回迁美国的困难。
对乙酰氨基酚只是目前在中国生产的大量原料药(API)之一,大多数 API 是美国制药商发现无利可图...
|

|
美国政府开始招标储备关键原料药
2020.08.05
美国政府正在储备可用于在未来大流行或国家紧急情况下用于生产基本药品的原料药(API),以期为美国药物供应链增加一层保护。
美国储备库之前仅限于医疗机构需要用来应对诸如飓风、大流行或炭疽爆发的药品和医疗用品。现在生物医学高级研究与发展局(BARDA)正在征求在政府战略国家储备...
|

|
美国司法部展开对制药商亚硝胺杂质虚假宣称的调查
2020.08.05
美国司法部已开始调查制药商是否没有透露畅销胃灼热药物雷尼替丁(商品为 Zantac,善胃得)中亚硝胺致癌物的信息而违反《虚假宣称法》。
赛诺菲和葛兰素史克两家公司在上周的证券文件中披露,他们在 6 月份收到了美国司法部对于可能违反《虚假宣称法》(FCA)信息的民事调查要求,...
|

|
FDA 辅料数据库更新,开始添加最大每日暴露量
2020.08.04
美国 FDA 于 7 月 29 日宣布已开始向辅料数据库(IID)中添加最大每日暴露量(MDE),预计将在 10 月之前完成。辅料行业组织对此表示支持,但希望 FDA 在完成 MDE 添加之前保留最大含量限度信息,否则可能会造成更多混乱。
MDE,也称为最大每日摄入量,是基于使用辅料的制...
|

|
国际监管机构就 COVID-19 治疗药临床试验终点达成...
2020.08.04
随着更多有关 COVID-19 潜在治疗药物的临床试验正在进行中,国际监管机构已就主要临床终点达成一致,终点的可接受性主要取决于所涉及的试验人群是中度至重度感染的住院患者还是轻度感染的门诊患者。
国际药品监管机构联盟(ICMRA)在 7 月 31 日发布的一份最新报告中解释了用于治疗 C...
|

|
【一周回顾】2020.07.27-08.02
2020.08.03
国家局公开征求药品上市后变更管理办法意见,药审中心发布 2019 年药品审评报告。识林讲座“FDA 对美国本土外制药的监管未来”视频上线。WHO 发布制药用水 GMP 指南修订草案。FDA 发布在肿瘤药研发过程中设定内毒素限度的指南以及固体口服制剂分包装指南。另 FDA 公布三篇警告信和...
|

|
FDA公布2021财年GDUFA费率,申请费上涨场地费项目费下...
2020.08.03
美国 FDA 于 7 月 31 日宣布了仿制药使用者付费项目(GDUFA)II 期第四个年头 — 2021 财年(2020 年 10 月 1 日至 2021 年 9 月 30 日)的费率。申请费(无论是 ANDA 还是 DMF 申请费)是唯一上涨的费用类别,且涨幅显著。场地费和项目费均有所下降,相比 2020 ...
|

|
【周末杂谈】孤儿药审批与“霸王监管”
2020.08.02
从法院对肌无力综合症案件的裁决,看FDA是如何“强词夺理”地保护公众利益。
FDA推崇科学和理性监管。但当一家企业刻意钻法律的漏洞,为己利而损害公众健康,FDA还可以采用“魔高一尺,道高一丈”,貌似强词夺理的办法来保护公众利益。企业不服,可将FDA告上法院。告状总是为具体事项。...
|

|
WHO 发布制药用水 GMP 指南草案第一版修订稿
2020.08.01
WHO 于 7 月 30 日发布《GMP 制药用水》指南草案第一版修订稿,修订稿在 5 月份发布的指南草案的基础上做了比较大的改动。
5 月份 WHO 因采纳使用与蒸馏等效的非蒸馏方式纯化工艺结合适当技术来生产注射用水,而修订了自 2012 年起生效的制药用水指南。指南草案发布后经过...
|

|
FDA 固体口服制剂分包装有效期指南定稿
2020.07.31
美国 FDA 于 7 月 29 日发布《固体口服制剂单位剂量分包装产品有效期》定稿指南,指南可以让企业在大多数情况下无需进行额外的稳定性研究即可将固体口服制剂从原始容器分包装到单位剂量包装中。
FDA 在指南中指出,近几十年来,各种医疗机构对于固体口服制剂分包装到单位剂量容...
|
|
FDA 发布指南解决抗肿瘤药研发早期内毒素限度问题
2020.07.31
美国 FDA 于 7 月 28 日发布《在肿瘤药物和生物制品研发过程中设定内毒素限度》的指南草案,解决了肿瘤药物开发中研究用治疗药经常与其它已获批的治疗药结合使用,或与其它研究用药物联合使用的现实问题。指南介绍了 FDA 对于新药申办人在开发与其它已获批药物组合使用或共同开发...
|

|
FDA 仿制药批准后变更补充申请降级,变更审批加速
2020.07.30
美国 FDA 正在加快审评因 COVID-19 的影响而迫切需要的简化新药申请(ANDA)批准后生产变更补充申请。在这些加快的批准后补充申请中常见的变更涉及:生产场地;生产工艺调整;批量大小(例如,放大);容器密封系统;分析方法;原料药/辅料的供应商;以及质量标准等。
在某些情况下...
|