|
罕见病缺乏数据,FDA 研究称 AI 比传统建模更有办...
2025.12.15
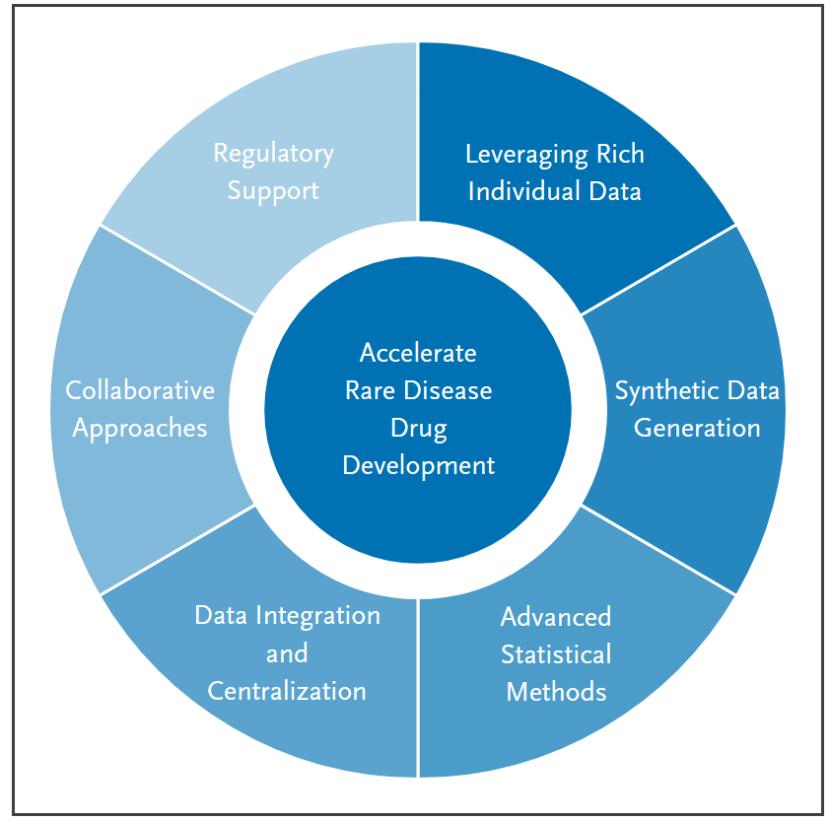
11月24日,FDA CDER研究人员在NEJM AI发表文章《应对数据有限带来的挑战,以促进人工智能在罕见病药物研发中的整合》,系统阐述了AI在罕见病药物开发中面临的数据稀缺问题及其应对策略。
罕见病因其“罕见”而缺乏数据,而传统建模过于依赖数据量,新一代的泛化型AI模型有望克服这...
|

|
FDA 认定其首个 AI 药物开发工具,正是 EMA 已认定...
2025.12.15
12月8日,FDA宣布正式认定Path AI的人工智能(AI)辅助工具“基于AI的非酒精性脂肪性肝炎组织学测量系统”(AIM-NASH)。
FDA通过药物开发工具(DDT)路径的生物标志物资格认定计划(BQP)全面审查Path AI提交的文件包,最终认定该药物开发工具适用于其特定使用场景(COU)。这也...
|

|
【周末杂谈】法院不认同 FDA 对“批准”一词的解释
2025.12.14
从特殊案例看,啥样的新药“批准”不算“批准”
优先审评券是FDA颁发的一种鼓励创新的凭证。例如,成功获批治疗儿童罕见病新药的企业可获奖励一张优先审评券,可将未来不符合优先审评资格的申请转为优先审评,将审评时间从10降至6个月。此券可在企业间买卖,价值可高达数亿美元。
2022年...
|

|
【轻松一刻】HITL,是有人就行?
2025.12.13
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转化为漫画,在识林平台上分享给大家。...
|

|
基于483和申报资料,FDA 全面审视冻干工艺
2025.12.12
12月初,FDA研究人员在AAPS期刊上发表了一篇题为《人用药申请和生产检查中观察到的药品冻干与控制策略的最新趋势》(Recent trends in pharmaceutical freeze-drying and control strategies observed in human drug applications and manufacturing inspections)的文献,系统...
|

|
FDA 敦促药企重视批准前检查,提醒多个细节
2025.12.12
FDA生物制品审评与研究中心(CBER)合规与生物制品质量办公室主任Melissa Mendoza在12月初的食品药品法研究所(FDLI)会上指出,生物制品申办者若希望避免收到完全回应函(CRL)导致拒批,必须确保其生产设施在提交上市申请时已准备好接受FDA的许可前检查(pre-license inspection,PL...
|

|
ICH 发布 E22 征求意见,将患者偏好纳入开发与审评...
2025.12.11
11月28日,ICH发布了《E22患者偏好研究的一般考虑》(暂译)征求意见稿,旨在为药物开发中患者偏好研究(PPS)的规划、设计、实施、分析和报告提供框架性技术建议。
我国CDE发布于2023年7月的《以患者为中心的药物获益-风险评估技术指导原则(试行)》中提及患者偏好信息(patient pref...
|
|
ICH 启动 E23 新指南制定,推进真实世界证据支持药...
2025.12.11
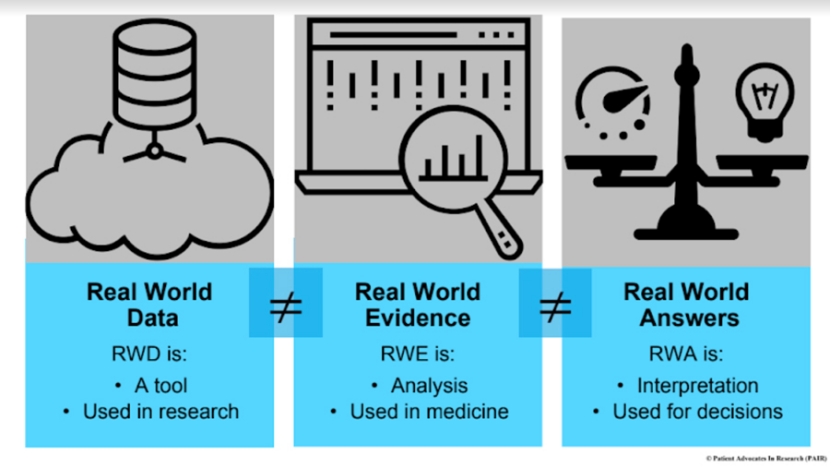
11月28日,ICH发布了一份概念性文件,正式启动新指南《E23:关于使用真实世界证据(RWE)支持监管决策的考虑,重点关注药品有效性》(暂译)的制定,旨在解决当前全球范围内在真实世界数据(RWD)与RWE的定义、元数据规范及评估原则方面存在的差异与挑战。
ICH首先要解决的问题是定义...
|

|
PDUFA VIII 谈判动态:填补孤儿药漏洞,境外 IND ...
2025.12.10
FDA近期公布了多份新一轮《处方药用户费用法案》(PDUFA VIII)授权谈判会议纪要,内容体现出PDUFA VIII可能引入的变化。
现行PDUFA VII将于2027年9月30日到期,尽管看似还有时日,但PDUFA VIII注定将由特朗普政府主导,谈判结果将直接决定2027-2032年FDA药品审评的经费来源,左...
|
|
FDA 官员 JAMA 发文提出 CAR-T 需证明优效
2025.12.10
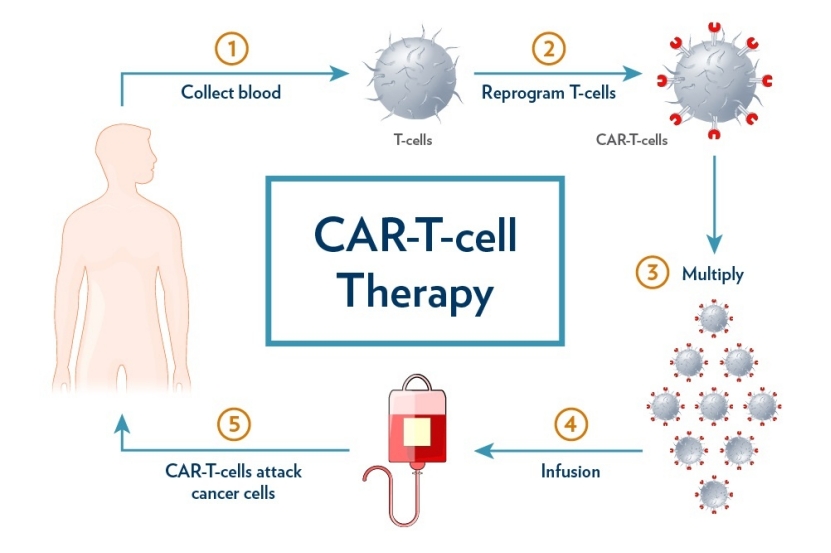
FDA生物制品审评和研究中心(CBER)官员在JAMA发表文章《推动CAR T细胞疗法:肿瘤学领域的CAR-T循证试验设计》(Advancing CAR T-Cell Therapy Evidence-Based Trial Design for Chimeric Antigen Receptor T-Cell Therapy in Oncology),系统阐述了CAR-T疗法在肿...
|

|
国际药政每周概要:FDA 减免单抗动物试验,部署智能...
2025.12.09
【早期开发与临床】
12.1,【EMA】关于修订帕金森病治疗药物临床研究指南的必要性的概念性文件
12.2,【FDA】单克隆抗体:简化的非临床安全性研究
【CMC 药学研究】
12.1,【EMA】附录1:N-亚硝胺的可接受摄入量(更新)
12.3,【PMDA】粪菌移植(FMT)产品在初始...
|

|
EMA 大幅修订变更分类问答,适配新版欧盟变更指南
2025.12.09
12月3日,EMA发布了《变更分类问答》重要更新版本。此次修订是自2019年以来规模最大的一次,除问答7.2.11与7.2.15外,其余部分均进行了调整。小至变更情形编号,大至新增问答,均旨在与9月22日发布的欧盟变更指南保持同步。
EMA提供了花脸稿(上面链接可下载),出口欧盟的药企必...
|

|
EDQM 拟更新2018年 CEP 变更指南
2025.12.09
12月3日,欧洲药品质量管理局(EDQM)发布了《关于修订/更新欧洲药典适用性证书的要求的指南》的征求意见稿,旨在更新和明确CEP(欧洲药典适用性证书)持有人在证书生命周期内进行信息变更、证书更新以及持有人转让所需遵循的规程与分类标准。现行版本指南发布于2018年10月,本次更新集...
|

|
FDA 将默认一项临床试验支持批准,局长继续推行“连...
2025.12.08
近期,FDA局长Martin Makary多次公开阐述名为“连续试验”(continuous trial)的改革构想。该构想旨在通过技术手段与监管程序创新,显著缩短药物从研发到获批上市的整体时间。
最新的动向是在12月3日接受STAT采访时,Makary拟进一步降低所有医疗产品的临床要求,将默认单项临床试...
|

|
法国药监启动14日临床试验快速审批试点
2025.12.08
近日,法国国家药品与保健品安全局(ANSM)宣布将于2026年一季度启动一项新型快速临床试验审批流程试点,旨在将国内临床试验的审批时间从当前的31日目标缩短至14日。ANSM指出,此举旨在应对“临床研究领域的激烈国际竞争”,其中试验许可与启动速度被视为“关键战略挑战”。
新快速审...
|

|
国内药政每周导读:CDE 分享仿制药重大缺陷清单,医...
2025.12.08
【早期开发与临床】
12.5,【CDE】关于发布《疫苗临床试验不良事件分级标准指导原则(修订版)》的通告(2025年第49号)
【CMC 药学研究】
12.3,【CDE】关于公开征求《化学仿制药药学研究重大缺陷(试行)(征求意见稿)》和《化学仿制药生物等效性研究重大缺陷(试行)(...
|

|
【周末杂谈】给 AI 在 GMP 上的应用,吹点凉风
2025.12.07
孤立地看,新技术确实有助降本增效,算总账就未必了
将AI用于GMP合规,是为了部分地代替人工、降低成本,怎会增加成本?
先来看看Word的历史。
新技术乍到时,人们常期望由此提高效率,降低成本。1989年,微软苹果版的Word软件可放在一张1.4M的软盘上。此前的文件,要么靠手写、要...
|

|
【识林诚聘】制药 AI 场景落地负责人(质量方向)
2025.12.06
识林“结构化知识库+大语言模型”的AI解决方案已在十多家药企落地,我们正在寻找30岁左右、具有药企生产质量一线经验,面向未来药企质量工作的AI场景落地负责人。
你将把真实业务场景与专业知识连接起来,让AI产品真正解决药企的问题。
这是一个拥抱未来的岗位:
不只是继续做质...
|

|
时隔8年 FDA 全面修订医用气体 CGMP,遵循21 CFR 2...
2025.12.05
11月28日,FDA发布《医用气体 - 现行生产质量管理规范》的行业指南草案,全面修订并取代2017年的征求意见稿。本次草案的发布标志着FDA对医用气体这一特殊药品类别的监管框架完成了重要更新。
识林数据库显示2003年和2017年版本的医用气体CGMP均为征求意见,一直未定稿。用“花脸稿...
|

|
前局长们联名批评之际,Makary 选择疫苗怀疑论者接手...
2025.12.05
12月3日,在前任CDER主任Pazdur宣布退休(最新消息是FDA安排其退休前回归肿瘤卓越中心)次日,FDA局长Marty Makary任命长期对新冠疫苗持怀疑态度的Tracy Beth Høeg为CDER代理主任。
至此,CDER在今年内已更换至第五位负责人。
Høeg专业背景为运动医学医生和流行病学家,无长期F...
|