
|
疫情加速 FDA 对真实世界数据的使用
2021.01.28
美国 FDA 已推进真实世界数据的使用来应对新冠(COVID-19)大流行,利用这些数据来了解疾病、规划临床试验以及管理医疗产品供应链以预防短缺。
FDA 首席副局长 Amy Abernethy 在 12 月举行的 FDA/CMS 峰会上介绍了 FDA 在大流行期间对于真实世界数据使用的进展。她表示,FDA与 Re...
|

|
新全球联盟推动分散式临床试验的实施
2020.12.15
12 月 10 日,一个新的国际联盟 — https//dtra.org/dtra-launches-to-democratize-and-accelerate-clinical-trials/ 分散式试验与研究联盟(DTRA)启动,目的是解决整个研究界利益相关者在有意义地采用分散式试验方面持续面临的“重大障碍”。目前成员有 50 个组织,包...
|

|
FDA 定稿指南为增强临床试验人群多样性提供建议
2020.11.11
美国 FDA 于 11 月 9 日发布题为《增强临床试验人群的多样性 — 资格标准、入组实践和试验设计》(Enhancing the Diversity of Clinical Trial Populations — Eligibility Criteria, Enrollment Practices, and Trial Designs)的定稿指南,鼓励药品和生物制品申...
|

|
英国 MHRA 发布使用真实世界证据的随机对照试验指南
2020.11.02
英国药品与医疗保健产品监管机构(MHRA)正在制定一系列关于真实世界证据的指南文件,现已发布第一篇关于在随机对照试验(RCT)中使用真实世界证据(RWD)来支持监管申报的指南。之后的系列指南将分别基于不同类型试验设计中真实世界证据的使用来给出建议和期望。
MHRA 表示,最可能考...
|

|
临床试验中关于人工智能干预措施的报告共识标准
2020.09.29
一项新的共识声明“CONSORT-AI 扩展”为涉及人工智能(AI)干预措施的临床试验报告制定了规则。CONSORT-AI 全称为合并的报告试验标准-人工智能(Consolidated Standards of Reporting Trials–Artificial Intelligence)扩展是一项新的报告指南,用于评估具有 AI 成分的干预措...
|

|
重新思考药品监管:加速快跑还是谨慎持重?
2020.09.17
最近在美印商会(USAIC)年度生物制品和医疗保健峰会上,业界讨论了一些有趣且存在争议的内容,关于新冠疫情是否为重新考虑药品监管流程提供了机会。
简化试验,加快监管进程
百康(Biocon)公司董事长 Kiran Mazumdar-Shaw 表示,大流行期间美国的曲速行动(Operation Warp Spe...
|

|
日本癌症中心建立亚洲临床试验网络,推动新型抗癌药的...
2020.09.17
日本国家癌症中心医院(NCCH)启动了一个新的亚洲试验网络,旨在推动新型肿瘤药的早期临床开发,并作为亚洲地区跨国合作的框架。
NCCH 表示,ATLAS((Asian clinical TriaLs network for cAncerS)项目的主要目标包括推进企业申办和研究者发起的关键试验、基因组医学,改善药物...
|

|
国际 CRO 组织发布白皮书和工具包促进分散式临床试...
2020.09.09
国际合同研究组织协会(ACRO)最近发布了一份白皮书和基于风险的框架以及行业最佳实践。由于 COVID-19 大流行,分散式临床试验的重要性日益凸显。
ACRO 希望其文件能够“帮助减轻不确定性,并减少对分散式临床试验模型采纳的由于。”虽然 COVID-19 大流行正迫使临床试验方法实现...
|

|
FDA 定稿指南明确对未能公开临床数据的企业罚款
2020.08.18
美国 FDA 发布了《有关 ClinicalTrials.gov 数据库的民事处罚》定稿指南。指南解决了 FDA 各中心应如何应对违反联邦法规要求,未能准确、完整地登记注册临床试验并在 Clinicaltrials.gov 网站上报告结果的责任方的问题。FDA 各中心包括药品中心、生物制品中心和器械中心。
FD...
|

|
国际监管机构就 COVID-19 治疗药临床试验终点达成...
2020.08.04
随着更多有关 COVID-19 潜在治疗药物的临床试验正在进行中,国际监管机构已就主要临床终点达成一致,终点的可接受性主要取决于所涉及的试验人群是中度至重度感染的住院患者还是轻度感染的门诊患者。
国际药品监管机构联盟(ICMRA)在 7 月 31 日发布的一份最新报告中解释了用于治疗 C...
|
|
FDA 发布指南解决抗肿瘤药研发早期内毒素限度问题
2020.07.31
美国 FDA 于 7 月 28 日发布《在肿瘤药物和生物制品研发过程中设定内毒素限度》的指南草案,解决了肿瘤药物开发中研究用治疗药经常与其它已获批的治疗药结合使用,或与其它研究用药物联合使用的现实问题。指南介绍了 FDA 对于新药申办人在开发与其它已获批药物组合使用或共同开发...
|

|
FDA 四篇定稿指南扩大癌症试验特殊人群入组标准
2020.07.13
美国 FDA 7 月 10 日发布了四篇定稿指南,分别针对脑转移瘤患者、HIV或乙肝或丙肝患者、器官功能障碍或既往和并发恶性肿瘤患者、儿童患者人群的癌症试验资格标准给出了指导意见,并给出了针对将儿童患者纳入癌症试验的最低年龄考虑。
这些指南由 FDA 药品审评与研究中心(CDER)...
|
|
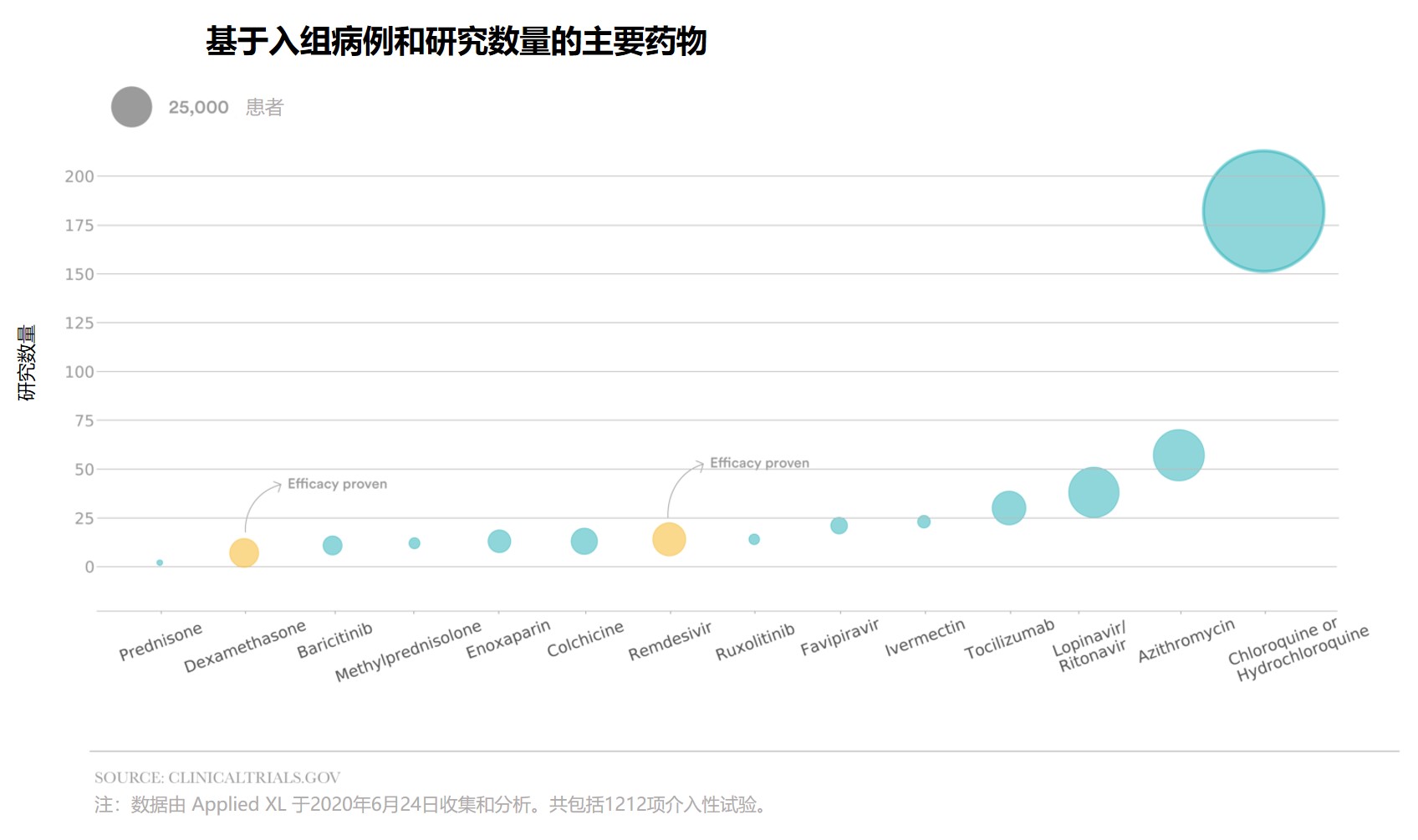
新冠药物临床研究:各自为战,缺乏统筹
2020.07.09
自今年新冠(COVID-19)爆发以来,研究人员针对 COVID-19 的治疗和预防措施设计了大批临床试验,雄心勃勃但混乱不堪,浪费了大量的财力和时间。
STAT 与 Newlab 公司下的 Applied XL 合作进行的一项分析发现,每六项临床试验中就有一项旨在研究抗疟疾药物羟氯喹或氯喹,而最...
|

|
创新临床试验:FDA 复杂创新试验设计试点案例与早期...
2020.07.04
美国 FDA 复杂创新试验设计试点成功经验的关键是:申办人准备就绪的、经过深思熟虑的试验设计,以及为 FDA 提供彻底审查复杂创新研究提案所需的所有数据。
行业参与者和来自 FDA 药品和生物制品中心的官员最近在药物信息协会(DIA)年会上分享了试点的早期经验。FDA 生物制品审评...
|
|
FDA 将发布分散式试验指南,或反映疫情中的经验教训
2020.06.30
FDA 即将发布分散式试验指南,或反映疫情中学到的经验教训
美国 FDA 即将发布的关于分散式试验的指南可能会反映在新冠(COVID-19)大流行期间从使用技术远程收集临床数据中获得的一些经验教训。
FDA 药品审评与研究中心(CDER)临床研究方法学、监管合规和医疗政策制定方面的官员 Isa...
|

|
肿瘤中心主任谈加速审批及新冠康复患者临床试验入组问...
2020.06.23
对多种加快路径做减法,系统化;如何更好地让新冠康复者参加临床试验
自美国 FDA 推出加速审批以来已经过去了将近三十年,现在是时候应该重新审视该路径以及 FDA 的所有加快计划了。FDA 肿瘤卓越中心主任 Richard Pazdur 在接受采访时表示,希望肿瘤学界重新审视 FDA 加速审...
|

|
临床试验现代化:欧盟就支持药品批准的数字技术方法确...
2020.06.11
数字技术越来越多地在临床试验中使用,例如,监测患者的临床相关参数、数字远程监控药物摄入以及在知情同意书上提供电子患者签名。可能使用的技术包括传感器(可摄入或植入物)、移动健康工具(例如,用于远程患者监控的可穿戴设备,与患者的的视频咨询,健康数据分析和数字记录系统)。最...
|

|
FDA 就建立罕见疾病临床试验网络公开征询意见
2020.06.03
美国 FDA 正在就如何建立和维持一系列罕见疾病的全球临床试验网络征求意见。这样的临床试验网络通常是由临床试验组织和医生的集合,可以在许多场地就给定的疾病领域展开协调和支持。该意见征询是 FDA“罕见病治疗加速计划”(Rare Disease Cures Accelerator)的一部分。
FDA 于 ...
|
|
人工智预测老年黄斑变性进展,帮助筛选临床试验最佳受...
2020.05.22
标志着预测疾病进展的重大进步,并可能有助于开发更有效的药物。
人工智能(AI)已经显示出通过分析医学图像来检测和诊断眼部疾病的能力不断增强。由谷歌和英国医生开发的新系统通过预测哪些具有共同病症的患者最有可能失明,在 AI 预测眼部疾病的道路上迈出了重要一步。
5 月 1...
|

|
适应性试验大热,FDA 复杂创新试验设计试点提供学习...
2020.05.19
5 月 13 日,药审中心发布《药物临床试验适应性设计指导原则》征求意见稿,旨在厘清药物临床试验中适应性设计的相关定义,明确适应性设计在临床试验中的注意事项和适用范围,以期为工业界利用适应性设计支持药物研发和注册上市提供科学可行的指导意见。指导原则梳理介绍了几种常用的适...
|