
|
EMA 建立多方利益相关者平台改善欧盟临床试验
2023.02.10
欧洲药品管理局(EMA)、药品机构负责人(HMA)和欧盟委员会(EC)呼吁研究界、制药申办人、学术界和监管机构的代表参与新的多方利益相关者平台(MSP),以分享和实施改进欧盟临床试验的想法。
MSP 是根据去年 EC-HMA-EMA 的加速临床试验倡议(ACT EU)发起的。ACT EU旨在改变临...
|

|
FDA 局长和生物中心主任联名呼吁对生物治疗产品开展...
2023.02.08
美国 FDA 局长 Robert Califf 和生物制品审评与研究中心(CBER)主任 Peter Marks 于上个月在《科学·转化医学》杂志上联合撰写社论,呼吁对包括近年来热门的粪便微生物移植疗法在内的生物治疗产品开展适当设计且对照良好的随机试验,以获得有关安全性和有效性的明确证据。社论...
|

|
欧盟新临床试验申请强制使用临床试验信息系统(CTIS)
2023.02.07
从2023年1月31日起,所有在欧盟(EU)的初始临床试验申请必须通过临床试验信息系统(Clinical Trials Information System,CTIS)提交,CTIS现在是申办者和临床试验监管机构提交和评估临床试验数据的单一入口。CTIS于2022年1月31日上线,是根据欧盟临床试验法规(Regulation (EU) No 53...
|

|
FDA 发布有关外部对照试验设计和实施的指南草案
2023.02.03
美国 FDA 于 1 月 31 日发布了题为“药品和生物制品外部对照试验设计和实施的考虑因素”的指南草案,指导申办人利用外部控制,例如使用来自登记库和电子健康记录的数据,代替来自随机对照试验(RCT)的数据来证明新药和生物制品的安全性和有效性。
该指南草案是 FDA 根据《21 ...
|

|
美众议员致信 FDA 和 NIH 质疑对临床试验结果公开...
2023.01.20
美国众议院能源和商业委员会副主席 Frank Pallone 于 1 月 19 日致信 FDA 局长 Robert Califf 和美国国立卫生院(NIH)代理主任 Lawrence Tabak 表达了对医药产品申办人不遵守向 ClinicalTrials.gov 数据库报告临床试验结果信息要求的担忧。
美国联邦法律要求某些临床试验申办人向...
|

|
FDA 临床试验暂停逐年增加,先进细胞和基因疗法临床...
2023.01.11
随着制药行业逐渐转向探索有前景但未经证实的前沿技术,美国 FDA 越来越频繁地要求制药公司停止对研究性药物的试验。
在企业开始上人体试验之前,通常都需要获得 FDA 的许可,FDA 一直以来都可以出于安全考虑而利用其法定授权要求企业暂停试验。根据日前华尔街日报对 FDA 临床暂...
|

|
欧盟和英国兴起的远程分散式临床试验
2023.01.05
远程分散式临床试验正在欧盟和英国兴起。关于此类临床试验,欧盟曾出台相关指引。2022 年 12 月,欧盟发布了关于如何开展此类临床试验的新指引,对现有指引进行了补充。为此,盛德主办律师 Zina Chatzidimitriadou、资深主办律师 Lauren Cuyvers和实习律师 Bronwyn Tonelli 探讨...
|

|
欧盟发布临床试验中的分散元素建议文件
2022.12.20
欧洲药品管理局(EMA)、欧盟委员会(EC)和药品机构负责人(HMA)承认分散元素在临床试验中的作用越来越大,并于 12 月 14 日发布了《临床试验中分散元素的建议文件》,重点是确保试验参与者的安全性和数据可靠性。
建议文件指出,医药产品的临床试验已经采用了一些分散式元素,包...
|
|
罗氏阿尔茨海默药 gantenerumab 两项3期临床试验失...
2022.11.16
瑞士制药商罗氏于 11 月 14 日披露,其抗淀粉样蛋白药物 gantenerumab 在两项早起阿尔茨海默病 III 期试验中失败,不仅没有达到减缓临床衰退的主要终点,β-淀粉样蛋白的去除水平也低于预期。
罗氏在新闻稿中表示,与安慰剂相比,gantenerumab 分别减缓了 8% 和 6%...
|

|
临床试验结果公开:美国立卫生研究院开始对未遵守报告...
2022.11.10
最近几周,美国国立卫生研究院(NIH)开始对未能向政府数据库提交临床试验结果的学术机构发送电子邮件。
临床试验注册和结果报告工作组表示,截至本周,NIH 已联系了二十多家机构。该工作组是一个由学术医疗中心、大学、医院和非营利组织组成的国家联盟,专注于临床试验的透明度。工作...
|

|
FDA就临床试验中多个终点的问题提供指导
2022.10.24
美国 FDA 于 10 月 20 日发布了“临床试验中多个终点”定稿指南,以最大限度减少对药物疗效做出错误结论的可能性。
FDA 表示,“在药物开发中进行的大多数临床试验都包含多个终点,以评估药物疗效并记录药物对一种或多种疾病特征产生有利影响的能力。当在一次试验中分析多个终点...
|

|
信达遇阻后,FDA召开会议提示肿瘤药申请人应如何开展...
2022.09.29
肿瘤药物申请人出于多种原因到美国以外进行临床试验,包括批准速度影响,美国不断更新护理标准以及国外患者入组更快,Me-too药面临的创新,企业基地影响以及与美国临床中心签订合同的困难等。对此肿瘤卓越中心(OCE)主任Pazdur表示希望保持真正的临床多样性。
美国FDA肿瘤卓越中心于...
|

|
JAMA研究发现抗癌药物临床试验数据公开仍旧艰难
2022.09.07
监管机构和临床医生是否批准和使用新药通常取决于关键临床试验的结果。对于大多数新药,药品申请方推动了支持该药物的早期证据基础,但这一过程的促进需要提高全球医疗系统的可及性。至少在药品上市后数据进一步完善之前,早期临床试验的数据仍然是安全性和疗效评估的核心。2021年5月,WHO...
|

|
新冠挑战,资源挤占,数据可靠性,WHO倡议加强全球临...
2022.06.06
新冠肺炎疫情对全球临床试验产生了深远影响。COVID-19疫苗和疗法的研发如火如荼,但其他治疗领域的临床试验却受到了相当大的干扰,尤其是心血管、皮肤病学和代谢学。虽然FDA和EMEA等重要监管机构均推出了维护临床试验完整性的指导方针和措施,试图在COVID-19大流行期间保障患者和医护人...
|
|
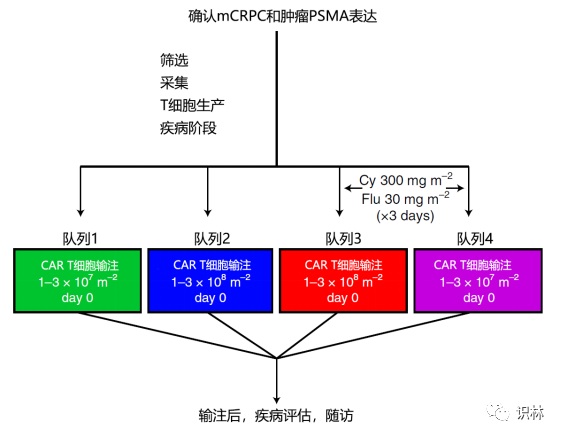
Nature 子刊论文:实体瘤 CAR-T 的关键挑战,以及...
2022.05.13
CAR-T 细胞治疗从根本上改变了血液系统恶性肿瘤的治疗格局。FDA 也在前不久发布了专门指南,见相关资讯:【FDA 发布 CAR-T 细胞治疗的研发考量指南草案】
CAR-T 治疗在血液肿瘤中的成功激发了人们对该技术在实体瘤中应用的热情。然而,实体瘤的生物学比血液系统恶性肿瘤更复杂。去年...
|

|
FDA首席副局长Woodcock撰文,谈美国临床试验多样化
2022.04.07
近日美国FDA首席副局长Woodcock在JAMA发布了一份研究报告,题目为“2015-2019年美国新药和生物制品临床试验中的种族(Racial)和族群(Ethnic)代表性”,以了解美国临床试验中的受试者在多大程度上代表了美国的人口多样性。
2015-2019年期间的517项临床试验1中,来自美国试验场地的受...
|

|
FDA 定稿三篇关于抗癌药开发临床试验的重要指南
2022.03.02
美国 FDA 于 2022 年 3 月 1 日发布了三篇关于抗癌药开发的定稿指南,重点关注两个重要概念:主方案(master protocols)和扩增队列(expansion cohorts),并强调了癌症临床试验应如何包括 75 岁以上的参与者。
FDA 在新闻稿中表示,这三篇定稿指南的发布是为了配合美国...
|

|
英国 MHRA 总结新冠疫情期间临床试验经验
2022.02.17
英国药品与医疗保健产品监管机构(MHRA)在其官方博客中回顾了在新冠大流行期间对于临床试验所学到的经验教训以及如何利用这些经验构建英国临床试验生态系统并最终使患者获益。
在大流行开始时,MHRA 指派了专门的新冠审评员,并制定了预评估试验文件的流程,因此在方案和支持文件最终...
|

|
FDA 提供三个复杂创新试验试点试验设计案例研究
2022.01.22
美国 FDA 最近更新了三个案例研究,展示了申办人如何使用 FDA 的复杂创新试验设计(CID)试点会议计划将创新研究设计纳入其临床试验。
FDA 官员曾在去年夏天的 DIA 年会上分享过一些 CID 试点案例的早期经验。现在,FDA 整理发布了三个案例,目的是帮助申办人了解在提出 CID...
|

|
欧盟新临床试验系统将于月底上线,申办人应注意哪些问...
2022.01.18
欧盟新临床试验信息系统(CTIS)将于 2022 年 1 月 31 日上线,届时欧盟临床试验的实施和监督将发生根本性转变,为临床试验法规(第 536/2014 号)的生效铺平道路。
CTIS 由欧洲药品管理局(EMA)开发,旨在帮助实现 2014 年 4 月临床试验法规通过时所承诺的诸多好处,例...
|