
|
自然杂志撤稿:诺华重磅 Zolgensma 再现新早期数据...
2022.10.13
诺华重磅基因疗法、脊髓型肌萎缩症(SMA)治疗药 Zolgensma 近日再次受到早期研究数据可靠性问题的挑战,虽然可能并不会影响 Zolgensma 目前的批准和商业销售,但这已是该药自批准以来第二次被发现早期小鼠研究的数据存在虚假陈述。
上周,《自然·生物技术》杂志发现了 Zolgensma...
|

|
十年生产质量问题,一遭关停 — 印度仿制药巨头关闭...
2022.08.24
昨日我们报道了印度最大仿制药商之一太阳药业最近收到的一封 483,涉及倒填文件和伪造记录等数据可靠性问题。今天我们来看看另一印度仿制药巨头 Wockhardt 在美国的一家工厂十年间持续发生生产质量问题而最终决定关停的故事。
上周,美国司法部提起诉讼,指控 Wockhardt 位于伊利诺伊...
|

|
印度太阳药业再收 483,涉嫌倒填文件和伪造记录
2022.08.23
美国 FDA 于上周公布了一份 483 检查报告,对象是美国最大的仿制药供应商之一太阳药业(Sun Pharmaceutical),483 中的缺陷涉及倒填文件和伪造记录。
FDA 对太阳药业位于印度 Mohali 的一家工厂的的检查日期为 2022 年 8 月 3 日到 12 日,FDA 检查员检查了与一批药...
|

|
新冠挑战,资源挤占,数据可靠性,WHO倡议加强全球临...
2022.06.06
新冠肺炎疫情对全球临床试验产生了深远影响。COVID-19疫苗和疗法的研发如火如荼,但其他治疗领域的临床试验却受到了相当大的干扰,尤其是心血管、皮肤病学和代谢学。虽然FDA和EMEA等重要监管机构均推出了维护临床试验完整性的指导方针和措施,试图在COVID-19大流行期间保障患者和医护人...
|

|
因印度 CRO 严重数据可靠性问题,EMA 暂停约100种...
2022.05.24
EMA于5月20日发布通知【EMA 声明】1,由于 Synchron 进行的试验存在问题,建议暂停约100种仿制药的上市许可(部分药物在某些欧盟国家可能至关重要,比如缺乏可用的替代品,这些国家的监管机构可以推迟此次暂停)。
具体来说,EMA 指出了对位于印度艾哈迈达巴德的 Synchron 开...
|

|
研究人员举报辉瑞新冠疫苗试验数据可靠性问题,FDA ...
2021.11.05
2021 年 11 月 2 日发表在英国医学杂志(BMJ)上的一篇调查文章1备受关注,文章报告了内部举报人对帮助开展辉瑞关键新冠疫苗试验的合同研究公司的不良做法的揭露,引发了人们对于数据完整性和 FDA 监管监督有效性的担忧。
文章的信息来自于研究组织 Ventavia 研究集团的一名地...
|
|
印度两 CRO 存在严重数据可靠性问题,制药商需重做...
2021.10.02
美国 FDA 罕见地通知了无数制药商,由于印度两家为制药业开展研究的公司存在严重的数据问题,因此他们做的一些临床试验必须重做。
根据 FDA 9 月 16 日发布的https//www.fda.gov/drugs/drug-safety-and-availability/notification-pharmaceutical-companies-clinical-and-bioanal...
|
|
ISPE 会上关于数据可靠性、欧盟无菌附录以及常见 GM...
2021.09.29
国际制药工程协会(ISPE)9 月 24 日举办的生物技术会议和研讨会的一个小组讨论会上,澳大利亚监管机构检查负责人分享了有关数据可靠性、欧盟 GMP 附录 1,以及影响受监管制药行业的其它问题的看法。
数据可靠性问题
在小组讨论上,监管机构被要求评论虚拟审计如何影响他们在...
|

|
WHO 新发布数据可靠性定稿指南,扩大适用范围
2021.03.31
世界卫生组织(WHO)于 3 月 29 日发布了第 55 届药物制剂规范专家委员会(ECSPP)技术报告 1033(TRS 1033),定稿了大批指南和标准,其中包括数据可靠性指南,对行业和检查人员都极为有价值。
此次定稿的数据可靠性指南旨在取代 WHO 于 2016 年 5 月发布的《数据与记录管理...
|

|
FDA 列举可因数据完整性而拒审的情况并给出补救建议
2020.09.24
美国 FDA 官员在 9 月 10 日非肠道药协会(PDA)举办的会议上解释了他们在做出拒绝批准与公司数据完整性漏洞有关的新药申请决定方面的某些情形,并介绍了解决此类问题的成功策略要素。
FDA 药品审评与研究中心(CDER)合规办公室(OC)生产质量办公室药品质量处高级政策顾问 Brooke ...
|

|
微生物实验室中的数据完整性建议
2020.06.02
制药商应使用流程图来记录如何在微生物实验室中开展工作,并且应具有强有力的质量文化,鼓励员工在看到潜在问题或错误时能够“大声疾呼”。这些都将为解决实验室中的数据完整性问题大有助益。
以上这些建议由葛兰素史克负责全球审计和亚太地区审计工作的 Bruce Loxley 和 Amgen 公...
|

|
诺华基因治疗药数据操纵问题悄然平息
2020.04.01
诺华子公司 AveXis 因操纵用于 Zolgensma 基因治疗药物批准的数据而引发的数据完整性危机似乎已经悄然结束,美国 FDA 指示 AveXis 公司纠正问题,未施加任何惩罚。
问题的根源是诺华在向 FDA 披露 Zolgensma 的数据操纵方面存在延迟,诺华在 2019 年 3 月 Zolgensma ...
|
|
诺华前雇员起诉称因揭露数据错误而被解雇
2020.03.10
诺华公司一名前雇员称她因指出诺华关于眼用药 Beovu 的不正确安全性数据而被开除。
Zuhal Butuner 在去年 2 月份提起的诉讼中描述了她曾在 2018 年 3 月建议诺华就有关 Beovu(brolucizumab)的已发布安全性数据中的“重大错误”发布新闻稿或向医生发信,Beovu 当时是正在...
|

|
临床前和临床阶段的数据可靠性问题日渐受关注
2020.02.13
近年来,药品生产领域的数据可靠性(data integrity)问题受到了广泛审查,包括对 GMP 违规的警告信和执法行动,但人们也越来越关注导致临床(GCP)和临床前(GLP)违规的数据可靠性问题。临床前和临床研究中的数据可靠性问题会危及药品研发计划,需要申办人的密切关注以及与 FDA 的...
|
|
FDA 警告信数量增加时间缩短,原料药商应注意三大趋...
2019.11.07
美国 FDA 药品审评与研究中心(CDER)合规办公室主任 Donald Ashley 于 11 月 5 日在普享药协会(AAM)会议上对原料药(API)商提出了几项主要关切,指出了与供应链信息混淆、越来越多的数据可靠性问题以及导致召回的杂质问题相关的三大趋势。这些趋势基本与之前的报告类似,详见【FD...
|

|
FDA 公布诺华对数据操纵问题的 483 回复
2019.09.26
美国 FDA 于 9 月 24 日公布了 诺华公司在 8 月 23 日提交给 FDA 的有关其基因治疗药数据操纵问题的 483 回复。这份长达 59 页的回复函中指出,由于调查的“高度复杂”性而未能尽快将这一问题告知 FDA,并将问题责任归咎于两名 AveXis 高管。
诺华下属子公司 AveXis 公司...
|

|
FDA 公告对一家药商伪造文件的惩处
2019.08.22
美国 FDA 于 8 月 20 日在其新闻公告中表示向一家中国非处方药(OTC)制药商发出了一封警告信,内容涉及包括数据可靠性在内的 CGMP 违规行为。这是 FDA 不太常见地通过新闻公告和邮件订阅的形式公布其向某家公司发出警告信,宣传力度之大或许与公司所生产的产品性质有关,FDA ...
|
|
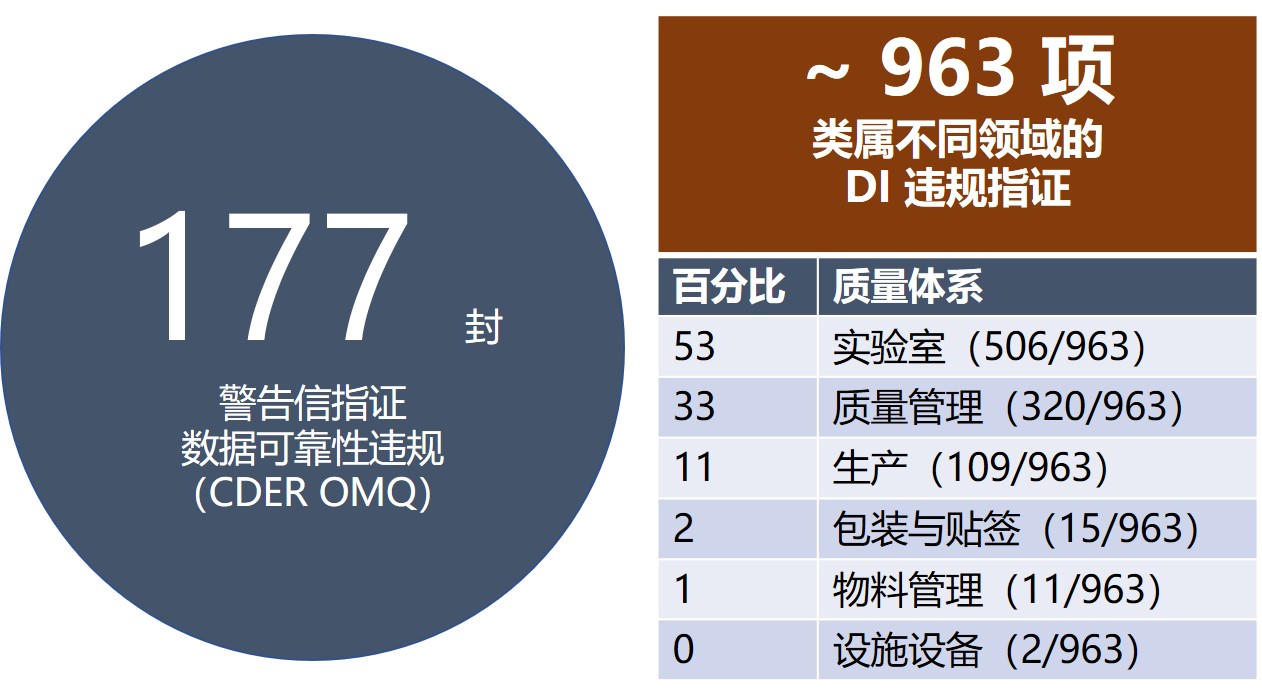
FDA 向国外发出的警告信四分之三涉数据可靠性
2019.08.13
昨天的资讯介绍了企业如何换个角度从监管视角审查自身问题,在监管检查之前发现隐藏的数据可靠性缺陷。今天我们从一些警告信观察项数据以及资深专业人士的建议来继续看看如何及早、高效的发现数据可靠性问题。
前 FDA 检查员、Parexel 咨询公司副总裁 Ron Tetzlaff 于 2019 年...
|

|
企业应从监管视角审查自身数据可靠性
2019.08.12
数据可靠性(data integrity, DI)监管合规专家观察到,行业内部和第三方审计人员通常不会发现数据可靠性失败,因为他们没有像 FDA 检查员那样查看系统和流程。即使在公司已经针对即将到来的检查执行了多次审计的情况下,监管机构也能识别出公司尚未发现或者尚未进行风险评估的 DI ...
|

|
诺华基因治疗药陷数据可靠性泥淖,知情迟报或加重问题...
2019.08.08
美国 FDA 严肃声明,诺华及其子公司 AveXis 公司可能会面临民事或刑事诉讼,不仅是因为操纵用于 Zolgensma 基因治疗药物批准的数据,更是因为公司在产品批准前就知道了这个问题但并没有向 FDA 披露。
FDA 生物制品审评与研究(CBER)主任 Peter Marks 在 8 月 6日的一份声...
|