
|
Catalent 比利时工厂再收 483,涉及数据、设备和 Q...
2022.10.26
Catalent 位于美国印第安纳州的工厂在收到来自 FDA 的 483 仅一个月后,其位于欧洲比利时的工厂同样收到了 483。
FDA 于今年 8 月份在 Catalent 位于比利时首都布鲁塞尔的生产场地进行检查后发布的 483 报告中列出了涉及无菌区空气过滤器问题、用于灌装的洁净间内 HVAC...
|

|
FDA 公布三封针对 Biocon 印度和马来西亚生物类似...
2022.09.26
美国 FDA 于 9 月 23 日公布了 Biocon Biologics 在印度和马来西亚三个生物类似药生产工厂的检查 483,三封 483 原文请点击查看:印度工厂1、印度工厂2、马来西亚工厂。
FDA 于今年 8 月 11 日至 30 日对 Biocon 公司在印度班加罗尔的两个工厂和马来西亚的一个工...
|

|
Alvotech修美乐生物类似药被拒,FDA公布13条工厂检查...
2022.09.16
本月初,冰岛生物技术公司 Alvotech 收到了美国 FDA 的一封完全回应函(CRL),针对的产品是 AbbVie 的重磅单克隆抗体修美乐(Humira)的潜在可互换生物类似药。CRL 中讨论了位于冰岛雷克雅未克工厂的几个缺陷。
9 月 13 日,FDA 公布了 3 月份对该设施检查的 483,共有 ...
|

|
十年生产质量问题,一遭关停 — 印度仿制药巨头关闭...
2022.08.24
昨日我们报道了印度最大仿制药商之一太阳药业最近收到的一封 483,涉及倒填文件和伪造记录等数据可靠性问题。今天我们来看看另一印度仿制药巨头 Wockhardt 在美国的一家工厂十年间持续发生生产质量问题而最终决定关停的故事。
上周,美国司法部提起诉讼,指控 Wockhardt 位于伊利诺伊...
|

|
全球仿制药巨头 Teva 关停在美工厂之一
2022.08.24
生产质量问题并不仅仅是印度公司的突出问题,全球数一数二的以色列仿制药商 Teva 于本周一表示将永久关停其位于美国加利福尼亚州尔湾的无菌注射剂工厂。
该工厂在过去十多年间一直问题不断,去年夏天 FDA 检查过后再次发出 483,Teva 当时暂停了该工厂的生产,而现在,Teva 决定...
|

|
印度太阳药业再收 483,涉嫌倒填文件和伪造记录
2022.08.23
美国 FDA 于上周公布了一份 483 检查报告,对象是美国最大的仿制药供应商之一太阳药业(Sun Pharmaceutical),483 中的缺陷涉及倒填文件和伪造记录。
FDA 对太阳药业位于印度 Mohali 的一家工厂的的检查日期为 2022 年 8 月 3 日到 12 日,FDA 检查员检查了与一批药...
|

|
FDA近年检查出哪些大问题?483、警告信和备忘录
2022.08.17
虽然FDA的检查活动在新冠肺炎疫情期间受到影响,但在过去一年半里有几个值得关注的通报。通报范围涵盖警告信、483表,以及被广泛公开的FDA关于紧急疫苗生产质量问题的备忘录。
像Teva Pharmaceutical这样的仿制药巨头以及像Catalent这样的合同生产商均被列入了FDA名单,这是2021年1月至2...
|

|
不是“远程检查”,也不发483,FDA发布远程监管评估问...
2022.07.29
为应对新冠大流行期间对行业的监管,FDA近日发布远程监管评估(Remote Regulatory Assessment,RRA)问答指南。指南中给出了RRA的定义,并提供了与RRA相关的16个常见问题解答,旨在帮助提高行业对RRA的理解,从而促进FDA开展远程评估的程序。值得一提的是,指南中明确表示RRA不符合FD&C...
|
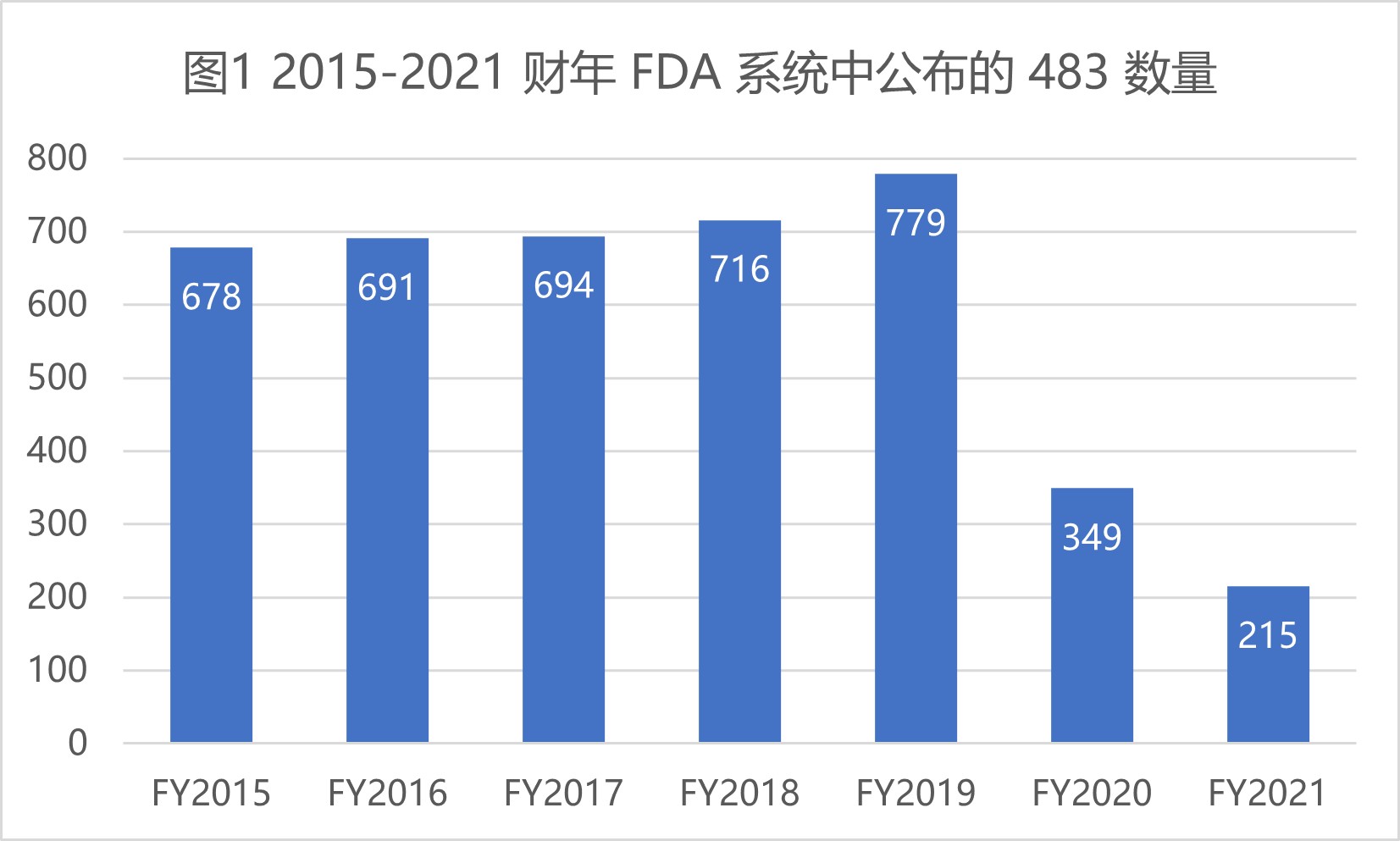
|
FDA 2021 财年药品检查观察项和趋势
2021.10.21
美国 FDA 于 2021 年 10 月 18 日最新发布了 2021 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
由于新冠疫情继续在世界绝大多数国家和地区肆虐,2021 财年 FDA 执行的检查数量仍然有限,而且执行的检查大多也是针对关键任务,涵盖面有限。所以...
|

|
礼来最新 483 揭露新冠抗体工厂生产质量问题
2021.08.17
美国 FDA 于 8 月 12 日公布了向礼来位于印第安纳波利斯的无菌注射剂生产场地发布的 483 报告,指出存在多项质量问题。
这些观察项是在 2021 年 2 月至 3 月间现场检查之后得出的,这次检查涉及在该工厂生产的多种药物:用于新冠的 bamlanivimab 和 etesevimab、用于...
|

|
FDA飞速检查新冠疫苗CMO并发布长达12页的483
2021.04.22
美国 FDA 于 4 月 21 日(周三)公布了其对 Emergent Bio Solution 巴尔的摩工厂的检查 483,总共 12 页,9 大观察项。
此次 FDA 行动速度之迅速,自上个月底 Emergent 被曝出在生产强生和阿斯利康的新冠疫苗可能存在交叉污染问题,强生将此情况报告给了 FDA。【CMO混淆...
|

|
FDA 2020 财年药品检查观察项和趋势
2020.11.28
美国 FDA 于 11 月 24 日最新发布了 2020 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
今年由于新冠(COVID-19)大流行的影响,FDA 自 3 月份宣布推迟所有境内和境外场地的常规监督检查,并在可能的情况下采用其它工具和方法进行批准前检查。【...
|

|
细胞与基因治疗产品常见 GMP 缺陷及质量管理挑战
2020.06.12
美国 FDA 检查员表示在对细胞和基因治疗产品的检查中更常发现设施和生产缺陷,而行业则表示,药品 GMP 并不总是适用于细胞和基因产品。
6 月 1 日举行的 ISPE 生物药制造网络研讨会上,FDA 官员在研究中指出,在 483 表报告的 GMP 缺陷中,比起其它类型的产品,细胞和基...
|

|
2019 年中国企业不合格 483(OAI)细读
2020.01.14
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|

|
零483代表什么 – 透过数据看合规
2020.01.07
注:在研究过程中,我们发现FDA提供的清单存在显著缺失,不少识林483数据库中已经收录的483并没有在其中体现,FDA对此备注说:并非所有的检查都收录在数据库里,不包括州检查、批准前检查、专论设施检查、等待最终执法行动的检查和非临床实验室检查。如果大家还发现有其它类型的缺失信息,...
|
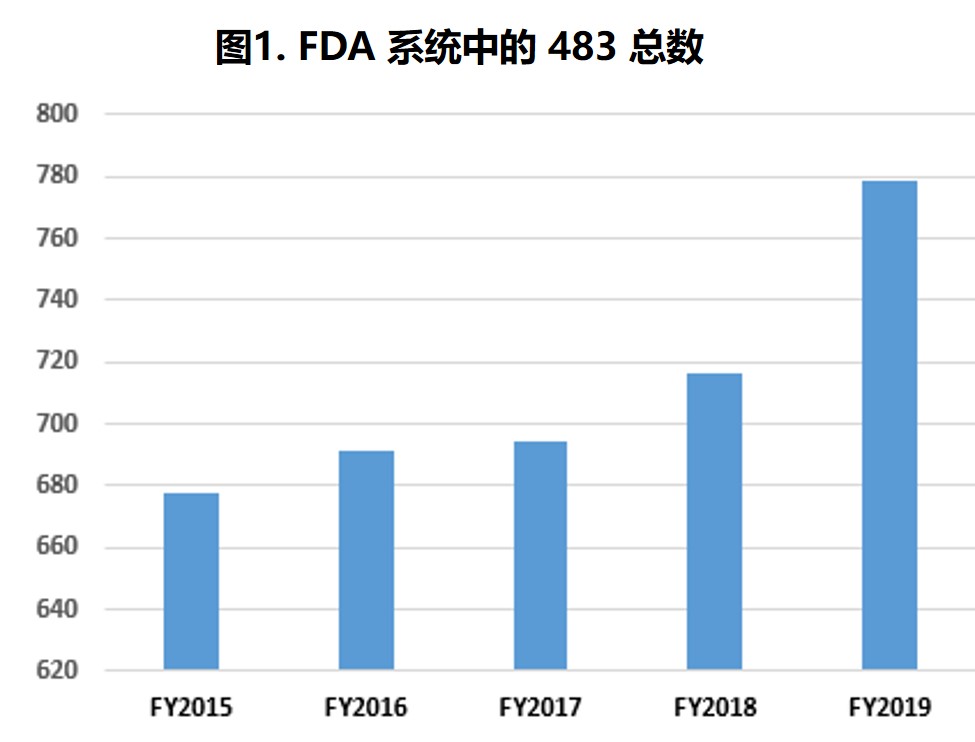
|
FDA 2019 财年药品检查观察项和趋势
2019.12.19
过去五个财年中,分析中所包含的 483 数量每年都略有增加,检查次数在 645 到 779 次之间(表1第2行和图1)。
自 2013 财年以来,指证 §211.192(偏差调查)失败的观察项在 2018 财年首次从名单魁首的位置上移下来。
2018 财年,§211.160(b)(实验室控制应包括科学合...
|

|
从教训开始学习 – 看看回复483有哪些常犯的错
2019.08.06
是不是检查结果不好就会收到警告信呢?根据识林483数据库(即将上线,数据库收录了美国FDA 过去十年近50000条检查信息和6000多封483报告原文,还可提供检查员信息等迎检定制服务),官方行动指示(OAI)最终转化为警告信的比例近似为20%(考虑到检查结果的升级和降级,这个比例是假设FDA...
|

|
数据可靠性带来了爱克龙的“凛冬”
2018.11.28
爱克龙再次因质量管理被FDA发出483信:
爱克龙(Akorn)是一家美国仿制药生产企业,专注于生产眼科用药,注射剂,口服液,耳药,局部药,吸入剂和鼻腔喷雾剂等。它的研究和生产设施分布在美国、印度及瑞士。仅在今年,其下属的两个生产设施(分别位于新泽西州萨摩赛特和伊利诺伊州迪凯特...
|

|
缬沙坦风波再起,FDA 公布两份华海检查 483
2018.08.11
美国 FDA 于周四公布了两份分别于2016 年 11 月和 2017 年 5 月签发给浙江华海药业的 483。虽然 483 观察项中涉及到的具体产品名称均被涂黑,但华海是缬沙坦原料药的主要供应商之一。FDA 此时公布这两份 483 意味深长,有可能是 FDA 在审查相关问题后主动公布,更有可能...
|

|
关于电子邮件回复 FDA 483 的更正和补充
2018.08.02
昨日识林发布【药企现可通过电子邮件回复 FDA 483】一文,介绍了美国 FDA 药品质量运营办公室(OPQO)鼓励制药商使用电子邮件提交 483 的简要情况。美国 FDA 驻华办的读者看到该资讯后提醒文中的一处疏漏,美国国内和国际检查回复的邮箱地址不同。
FDA 针对国外企业的回复邮箱地址应...
|