|
FDA 复杂仿制药申请日益增长,需分配更多审评资源
2021.11.24
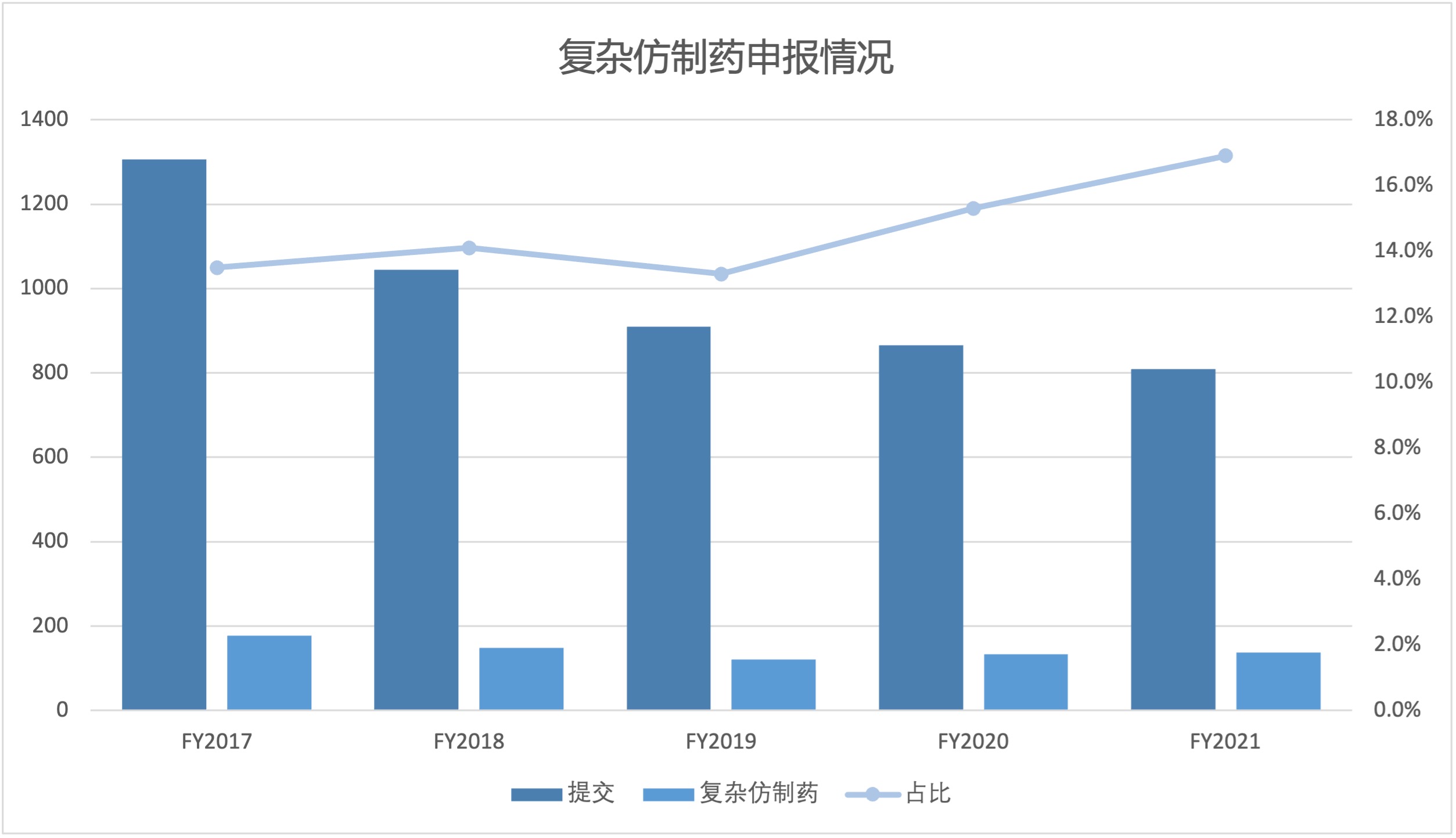
2021 财年,美国 FDA 复杂仿制药批准占所有简化新药申请(ANDA)批准的 13% 以上,自 2017 财年以来,复杂仿制药批准呈稳步增长趋势。随着复杂产品申请份额逐渐增加,FDA 可能需要调整其内部人员配备和其它资源来适应变化。
美国 FDA 仿制药办公室(OGD)研究与标准办公室 Robert L...
|
|
FDA 2021 财年仿制药批准数据趋势与分析
2021.11.09
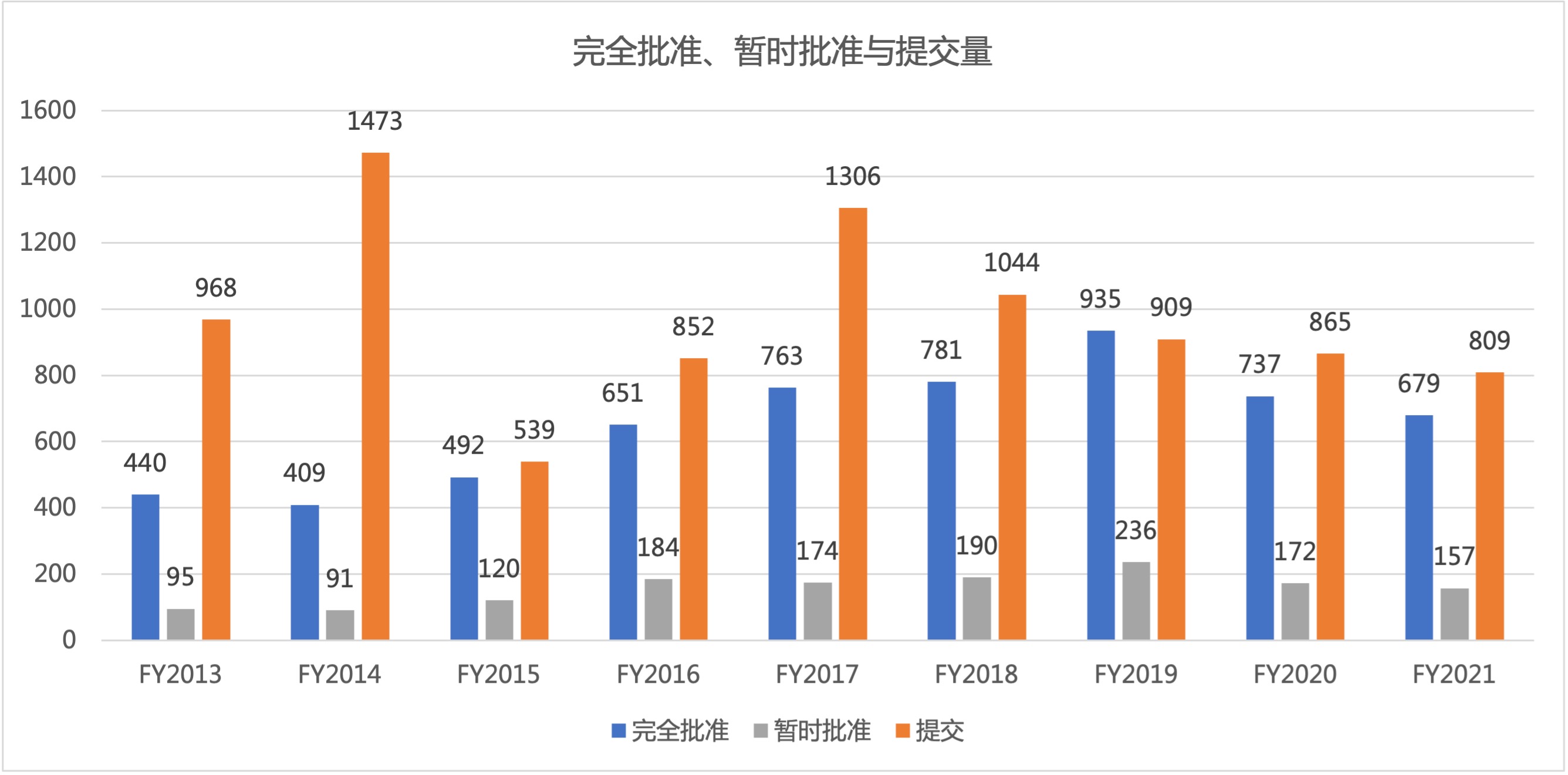
美国 FDA 仿制药办公室(OGD)公布了 2021 财年全部仿制药使用者付费(GDUFA)批准数据。2021 财年 FDA 报告了 679 件完全批准,这是自 2016 财年(650 件批准)以来最低的年度总数(见图 1)。2021 财年的批准总数比 2020 财年减少 58 件,比 2019 财年(935 件,创...
|

|
FDA 发布 GDUFA III 承诺函,增加对适用性请愿和...
2021.11.04
随着仿制药使用者付费修正案第三次迭代(GDUFA III)谈判的完成,美国 FDA 公布了其承诺函,其中列出了绩效目标和计划的改进。
GDUFA III 承诺函几乎是五年多前发布的 GDUFA II 期承诺函的两倍。FDA 在承诺函中写道,“该计划的新改进旨在最大限度地提高每个审评周期的效率和...
|

|
FDA GDUFA III 期会谈完成:收费将用于资助检查、...
2021.09.06
美国 FDA 和行业代表已就 2023-2028 年的仿制药使用者付费法案重新授权(GDUFA III)达成协议,其中将包括加强有关检查的沟通,以及对“即将批准”的简化新药申请(ANDA)的进一步澄清。
FDA 于 9 月 2 日表示,GDUFA III 谈判已经完成,行业和 FDA 利益相关者之间的批...
|

|
FDA 公布 2022 财年仿制药和生物类似药收费费率
2021.07.30
美国 FDA 于 7 月 27 日在《联邦公报》上分别公布了仿制药使用者付费项目(GDUFA)和生物类似药使用者付费项目(BsUFA) 2022 财年(2021 年 10 月 1 日至 2022 年 9 月 30 日)的费率。下面我们分别来看看。
GDUFA
GDUFA 的费率整体有所上涨,但幅度不大。最大的增...
|

|
FDA 2020 财年仿制药批准量下降,已达稳态?
2020.10.21
2020 财年已经结束,美国 FDA 仿制药使用者付费(GDUFA)的部分批准数据也已出炉。2020 年 FDA 报告了 737 件简化新药申请(ANDA)批准,这是自 2016 财年(650 件批准)以来最低的年度总数(见表 1)。2020 财年批准总数比 2019 财年减少了近 200 件,去年 FDA 创造了...
|

|
ANDA 合并与所有权转移均可能影响下一年仿制药缴费
2020.08.28
美国 FDA 仿制药办公室(OGD)于 8 月 26 日发布政策和程序手册《MAPP 5242.1 所有权转移》,介绍了 OGD 的橙皮书工作人员将如何处理由药品申请的前所有者和现所有者提交的转移申请所有权。
橙皮书是 FDA 发布的提供已批准的所有处方药的清单,包括对多家来源药品的治疗等...
|

|
FDA公布2021财年GDUFA费率,申请费上涨场地费项目费下...
2020.08.03
美国 FDA 于 7 月 31 日宣布了仿制药使用者付费项目(GDUFA)II 期第四个年头 — 2021 财年(2020 年 10 月 1 日至 2021 年 9 月 30 日)的费率。申请费(无论是 ANDA 还是 DMF 申请费)是唯一上涨的费用类别,且涨幅显著。场地费和项目费均有所下降,相比 2020 ...
|

|
FDA 仿制药批准后变更补充申请降级,变更审批加速
2020.07.30
美国 FDA 正在加快审评因 COVID-19 的影响而迫切需要的简化新药申请(ANDA)批准后生产变更补充申请。在这些加快的批准后补充申请中常见的变更涉及:生产场地;生产工艺调整;批量大小(例如,放大);容器密封系统;分析方法;原料药/辅料的供应商;以及质量标准等。
在某些情况下...
|

|
GDUFA III 谈判拉开帷幕,业界提出多条改进建议
2020.07.23
7 月 21 日,美国 FDA 举行了仿制药使用者付费修正案第三次重新授权(GDUFA III)公开会议,以从联邦机构、医疗机构、行业协会和其他利益相关者那里获得有关 GDUFA III 期重新授权准备工作的初步意见。
FDA 局长 Stephen Hahn 医学博士做了介绍性发言,仿制药办公室(OGD)主任 S...
|

|
美国新一轮药品收费谈判即将拉开序幕,GDUFA 谈判关...
2020.05.27
美国 FDA《处方药使用者付费法案》(PDUFA)重新授权的启动会议已定在 7 月 23 日举行,这将是 PDUFA VII(2023-2027 财年)续签谈判的正式开始。会议将在线举行,FDA 要求参会者需在 6 月 23 日之前https//www.fda.gov/drugs/news-events-human-drugs/public-meeting-reauthoriz...
|

|
【周末杂谈】积极参与规则的制定
2020.02.23
这周四,欧盟联合WHO和PIC/S起草和公布了无菌GMP附录的第二轮征求意见稿【欧盟无菌GMP指南第二轮征求意见稿发布】,这对我国药业是件重要的事。一是我国现行GMP就是参照欧盟GMP制定的,未来的修订可能还会参照。二是在近来国际形式巨变的情况下,欧盟、WHO和PIC/S这些多国国际组织的重要...
|

|
FDA 仿制药办公室发布 2019 年报
2020.02.21
美国 FDA 仿制药办公室(OGD)于 2 月 19 日发布 2019 年度报告,这是其发布的第五份年报,报告在形式上与以往相比有较大变化,更加面向公众,以通俗的语言解释了 OGD 所做的事情,而不是简单的数据和资料的罗列。从指南篇幅上看,本次的报告更加注重研究方面的内容,对于 OGD...
|

|
FDA 2019年仿制药项目的成功 - 为公共健康服务
2020.02.19
Serving Public Health Paramount in a Successful 2019 for FDA’s Generic Drug Program
By Sally Choe, Ph.D., Director, Office of Generic Drugs, Center for Drug Evaluation and Research
Safe, effective, high-quality https//www.fda.gov/drugs/buying-u...
|
|
FDA 仿制药积压已清理,批准神话难持续?
2019.12.09
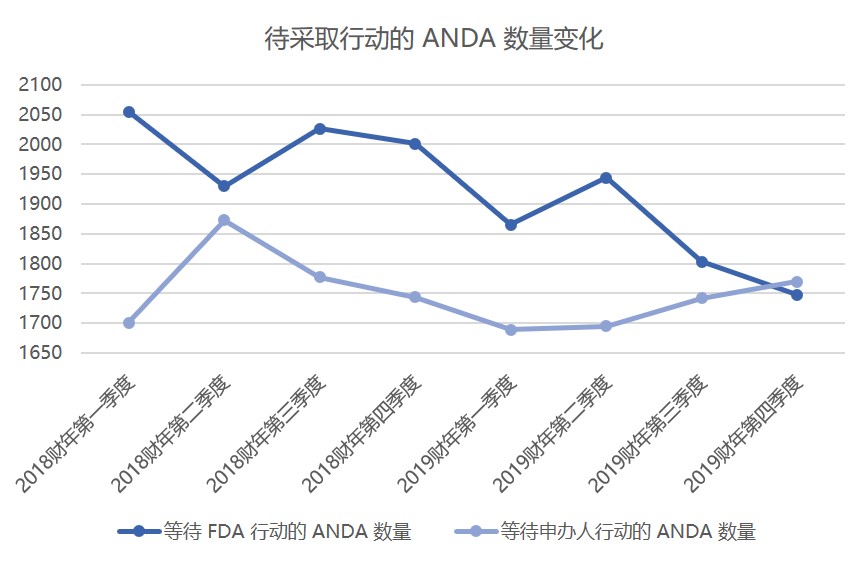
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 表示,近年来 FDA 接连创下仿制药批准数量记录的部分原因是大量申请积压。因此,由于 FDA 批准了现有积压的剩余部分,因此“可能不会保持”创纪录的年度仿制药批准。
Woodcock 于 12 月 3 日在 FDA/CMS 年会上表...
|

|
FDA 2019 财年仿制药批准破 900,批准量首超提交量
2019.10.19
2019 财年已经结束,自美国仿制药使用者付费计划(GDUFA)实施以来,这是 ANDA 批准行动数量首次超过提交数量(935 件批准,909 件新 ANDA 提交)。此外,FDA 仿制药办公室(OGD) 2019 财年以 935 件批准的成绩再次打破了批准记录,比 2018 财年 的 781 件批准多出 154 件(...
|

|
GDUFA 绩效报告显示仿制药审评时间有所改善
2019.10.08
美国 FDA 于 9月初发布了其递交给国会的 2018 财年仿制药使用者付费计划(GDUFA)绩效报告,报告中显示 GDUFA I 期(2013 财年-2017 财年)仿制药申请批准时间显著减少,反映了 FDA 和申办人在精简审批流程、完善申请资料方面的努力。
从 2013 财年到 2017 财年,ANDA...
|

|
2018 财年 GDUFA 科学与研究成果
2019.10.04
Each year, FDA prepares annual reports on the science and research-funded projects conducted under the Generic Drug User Fee Amendments of 2017 (GDUFA II) regulatory science program. These reports provide greater transparency regarding the important w...
|
|
FDA 仿制药批准再创纪录,但问题依旧
2019.08.19
美国 FDA 继续保持其仿制药批准大踏步前进,距财年结束还有两个月的时间,批准量已创历史新高。
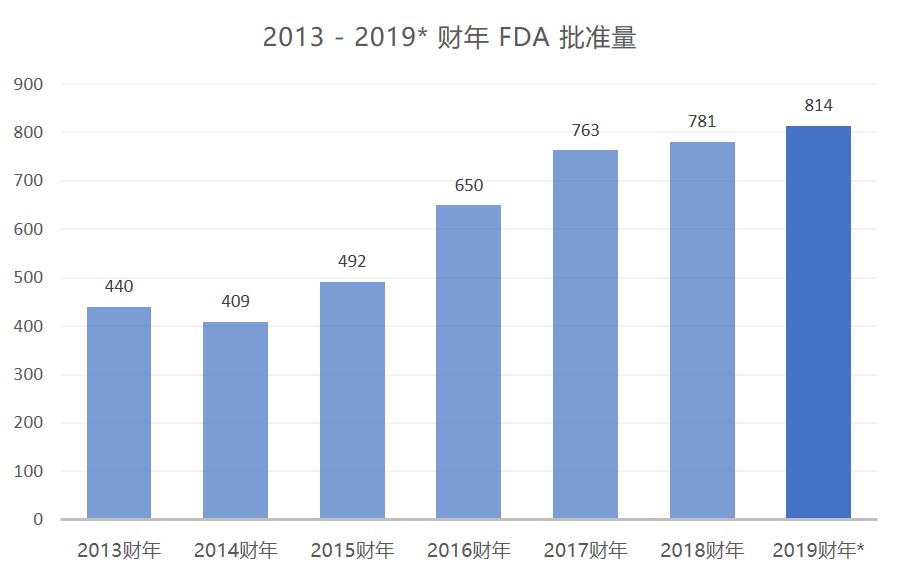
FDA 在 7 月份公布了 61 件 ANDA 完全批准后,本财年前 10 个月的批准总数已达 814 件,首次突破 800 并打破了 2018 财年 781 件完全批准的记录。按照此速度,FDA 在本财年...
|

|
FDA公布2020财年GDUFA费率,项目费大幅下降
2019.07.27
美国 FDA 于 7 月 26 日宣布了 GDUFA II 期第三个年头 — 2020 财年(2019 年 10 月 1 日起至 2020 年 9 月 30 日止) 的费率,大多数收费类别均有所下降,其中项目费降幅最大,下降了近 11%,相当于为大公司节省了二十万美元。
另外,由于 FDA 在设定 20...
|