
|
【一周回顾】2020.07.06-07.12
2020.07.13
识林推出 CAR-T 研发专题。WHO 发布瑞德西韦和地塞米松 BE 指南并邀请制药商提交药品评估意向书;公布在赛诺菲的 Priftin(利福喷丁)中发现亚硝胺杂质的情况。FDA 计划于本月恢复国内现场检查,发布四篇关于癌症临床研究资格标准的指南文件。欧盟发布人用药中的亚硝胺杂质评估...
|

|
FDA 四篇定稿指南扩大癌症试验特殊人群入组标准
2020.07.13
美国 FDA 7 月 10 日发布了四篇定稿指南,分别针对脑转移瘤患者、HIV或乙肝或丙肝患者、器官功能障碍或既往和并发恶性肿瘤患者、儿童患者人群的癌症试验资格标准给出了指导意见,并给出了针对将儿童患者纳入癌症试验的最低年龄考虑。
这些指南由 FDA 药品审评与研究中心(CDER)...
|

|
【周末杂谈】外行指导内行
2020.07.12
一份“外行”写的报告,导致美国57%的医学院关闭
两周前的“周末杂谈”提到普林斯顿高等研究院Flexner院长,未与爱因斯坦商量,就直接拒绝了罗斯福总统欢迎爱因斯坦去白宫做客的邀请。他还做过一件更非同寻常的事,那就是他在1910年发表的、长达346页纸的“美国和加拿大的医学教育”。...
|

|
抗结核药利福喷丁中发现亚硝胺杂质,来源与风险正在调...
2020.07.11
WHO 于 7 月 9 日公布了关于在赛诺菲的 Priftin(利福喷丁)中发现亚硝胺杂质的情况。WHO 预认证-药品评价小组(PQT/MED)基于 Priftin 在美国 FDA 的批准对该药进行了预认证。赛诺菲已暂停放行 Priftin 批次,同时正在考虑采取补救措施。WHO 指出,赛诺菲正继续就杂质问题与...
|

|
FDA 最新警告信显示溶剂回收商 GMP 合规困难重重
2020.07.10
美国 FDA 最近一封警告信值得制药企业和溶剂回收商关注,警告信揭示了有关原料药生产商保持溶剂回收的经济和环境效益而又不冒将潜在致癌杂质(例如,亚硝胺)引入药品风险方面的困难。
FDA 近日公布了其 6 月 17 日签发给印度 API 溶剂回收商 Vega Life Sciences 公司的警...
|

|
瑞德西韦:吸入剂试验启动,仿制药最低53美元一瓶,增...
2020.07.10
吸入溶液早期试验启动
吉利德(Gilead)于 7 月 8 日表示,已经开始对瑞德西韦(remdesivir)用于治疗新冠(COVID-19)的吸入溶液剂型进行早期测试。
吉利德表示,这一安慰剂对照试验将在美国招募约 60 名年龄在 18 到 45 岁的健康受试者,为进一步研究奠定基础,尤其是...
|
|
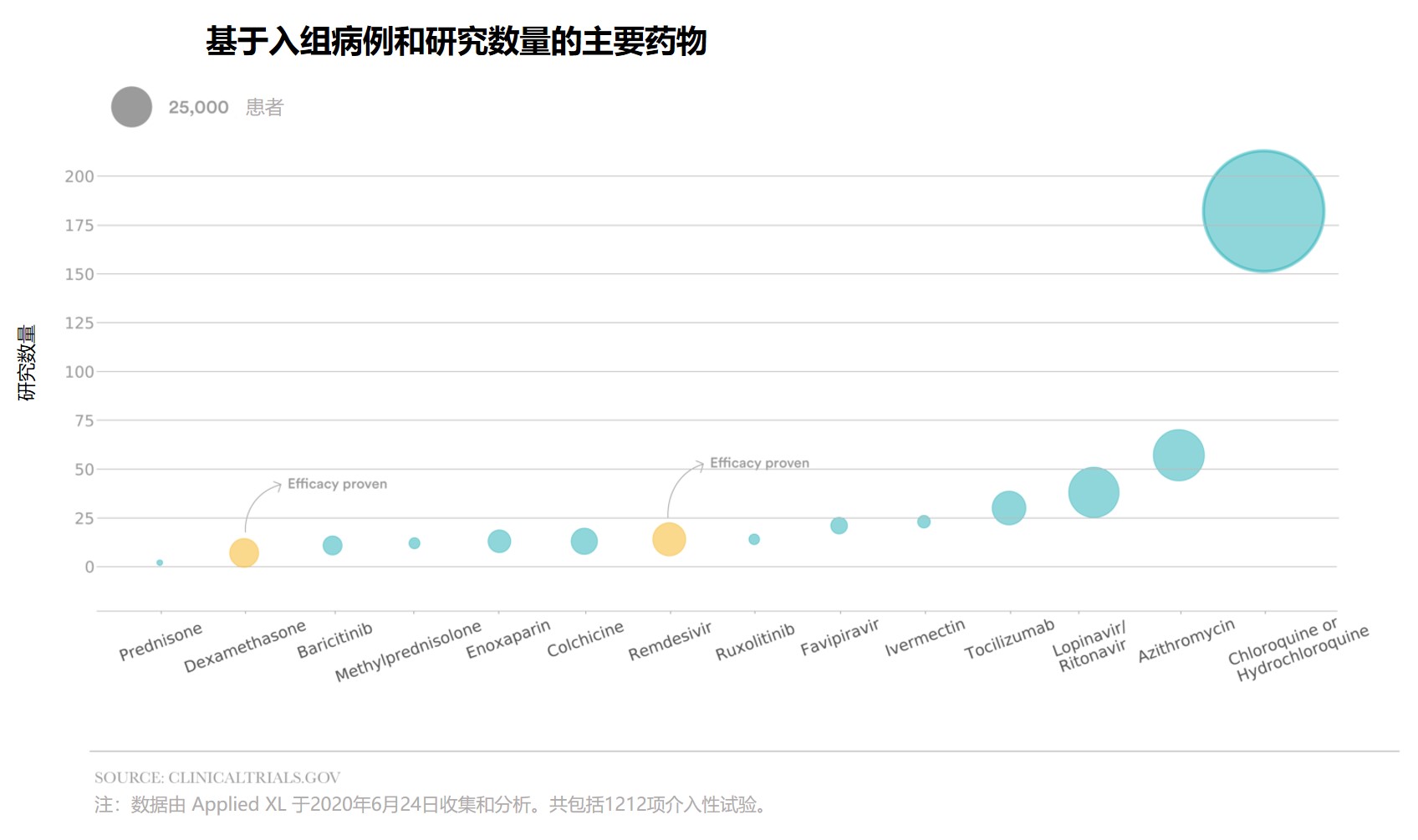
新冠药物临床研究:各自为战,缺乏统筹
2020.07.09
自今年新冠(COVID-19)爆发以来,研究人员针对 COVID-19 的治疗和预防措施设计了大批临床试验,雄心勃勃但混乱不堪,浪费了大量的财力和时间。
STAT 与 Newlab 公司下的 Applied XL 合作进行的一项分析发现,每六项临床试验中就有一项旨在研究抗疟疾药物羟氯喹或氯喹,而最...
|
|
WHO 计划发布细胞和基因疗法监管趋同白皮书
2020.07.09
WHO 计划很快发布白皮书,提出针对细胞和基因疗法的统一监管框架,促进中低收入国家的患者获得这些产品并增加商业可行性。美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 最近在由 PDA 主办的有关先进治疗药物产品的网络研讨会上如是表示。
Marks 在会上还讨论了将...
|
|
欧盟讨论疫情下药品供应的经验教训:协作,数据,生产...
2020.07.08
7 月 2 日药物信息协会(DIA)2020 欧洲会议上,与会者探讨了欧盟在大流行的头几个月中药品供应链方面的经验教训以及可能采取的确保将来可以更有效地解决供应问题和短缺的步骤。会上得出的一些结论和建议如下:
欧洲国家在冠状病毒大流行期间解决药品供应问题的方式分散,暴露了供...
|

|
FDA 发起多项研究了解处方药广告对患者和医生的影响
2020.07.08
标签和广告是药品监管的重要方面,且直接面向处方者和使用者(用户),只有准确了解用户通过标签和促销材料对药物的理解,才能更好地指导药品研发和监管,让制药商开发出来和监管机构批准的药真正实现预期用途。
美国 FDA 计划开展三项研究以评估处方药促销会如何影响医务人员和消...
|

|
药品申请数据化:抛弃 PDF,拥抱结构化持续更新数据...
2020.07.07
美国 FDA 最近数据策略现代化公开会议上,一个由多家制药公司发起的项目 — Accumulus 项目崭露头角。这一项目正在努力通过终止对“数字化纸质文件”(PDF 文件)的依赖来简化申请的提交和审评。
Accumulus 涉及创建一个平台,允许滚动数据流,而不是现在提交的在单个时间点的数...
|
|
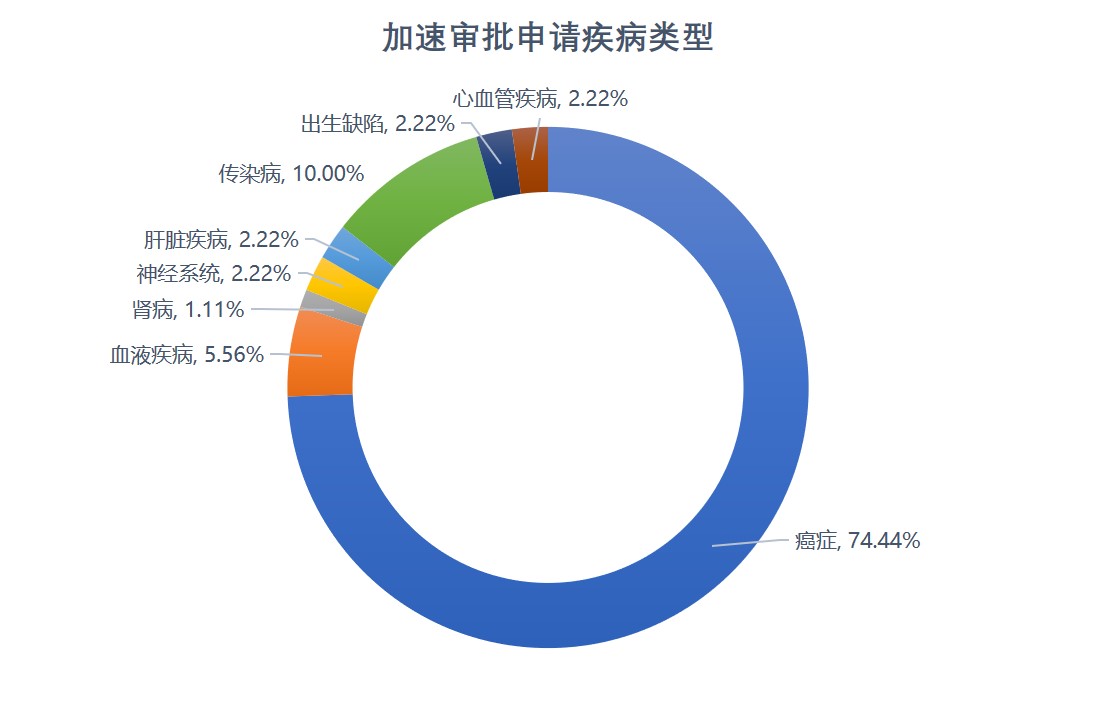
FDA 加速审批现状:问题与热度并存,抗癌药占大多数
2020.07.07
美国 FDA 加速审批计划实施已经超过 25 年了,FDA 正在着手评估该计划的未来,但是根据统计数据显示,2020 年可能出现创纪录的加速审批申请。
据 Pharma Intelligence 统计,FDA 2020 年到目前为止批准的新药和生物制品申请以及有效性补充申请中,超 14% 获得了加速审批,远高...
|

|
【一周回顾】2020.06.29-07.05
2020.07.06
上周国家局、药审中心发布了大量重要文件,包括药品检查管理规定征求意见稿、GMP 血液制品附录修订稿、药品记录与数据管理要求、化学药品以及生物制品注册受理审查指南等等。2020 版《中国药典》正式发布,实施日期为今年 12 月 30 日。《药品注册管理办法》已于 7 月 1 日开...
|

|
亚硝胺杂质带来的深远影响:GMP 要求扩大和前移
2020.07.06
前不久我们介绍了欧盟发布的关于亚硝胺杂质事件的经验教训报告,报告从多个方面给出了建议。【欧盟报告全面总结沙坦类药物中亚硝胺杂质的经验教训 2020/06/25】报告给出的建议都非常实际,其中关于 GMP 及相关指南修订方面的建议影响更为深远。今天我们就重点来看一看,亚硝胺杂质事...
|

|
【质量对话】采访一家质量标兵药企
2020.07.05
有这样重视质量的企业和老总,百姓怎能对药品质量不放心呢?
本文内容纯属虚构,如有雷同纯属巧合。欢迎大家耐着性子读完。
我刚拿到硕士学位,加入一家报社。念书时,选修过药品监管体系的课,所以,主任派我去采访当地一家刚在药品质量方面出了一点麻烦的著名药企、上市公司。主任...
|

|
创新临床试验:FDA 复杂创新试验设计试点案例与早期...
2020.07.04
美国 FDA 复杂创新试验设计试点成功经验的关键是:申办人准备就绪的、经过深思熟虑的试验设计,以及为 FDA 提供彻底审查复杂创新研究提案所需的所有数据。
行业参与者和来自 FDA 药品和生物制品中心的官员最近在药物信息协会(DIA)年会上分享了试点的早期经验。FDA 生物制品审评...
|

|
因为疫情警告信不能关闭怎么办?
2020.07.03
那些先前在美国 FDA 的检查中发现了严重质量问题的制药商,即使已经做了相应的整改纠正措施,可能也不得不等到新冠(COVID-19)疫情消退之后,FDA 重启后续场地检查,才可能会恢复与场地相关的申请的审评工作。
自 3 月中旬 FDA 宣布除最紧迫的“关键任务”检查外,推迟所有现场检...
|

|
FDA 新供应链数据报告要求,你开始准备了吗?
2020.07.03
美国 FDA 局长 Stephen Hahn 在生物技术创新组织(BIO)最近举行的网络会议上表示,FDA 需要更好地了解药品供应链和制药行业的能力。他希望工业界帮助创建所需的数据流以更新供应链状态。他表示,“我们需要了解供应链到底是怎么样的,我认为我们只有与行业紧密合作才能做到这一点。...
|
|
FDA 新冠疫苗开发与许可指南,首次提出明确保护效力...
2020.07.02
保护效力至少为50%,不会降低紧急使用授权门槛,替代终点短期内不可行
美国 FDA 于 6 月 30 日发布了《预防 COVID-19 的疫苗研发和许可》立即生效指南,为申办人设定了开发 COVID-19 疫苗的标准:保护效力(efficacy)至少为 50%。该建议旨在确保不会将资源浪费在仅有有...
|

|
可待因能否在某些具体基因型儿童中使用?FDA 公开征...
2020.07.02
目前的禁忌症可能导致 12 岁以下复发性急性疼痛的儿童使用阿片类镇痛药的机会减少。
美国 FDA 正在向公众https//www.regulations.gov/document?D=FDA-2020-N-1046-0001 征询意见:12 岁以下儿童如果已被证明不具有可能将可待因药物代谢到潜在毒性水平的遗传基因,是否...
|