
|
欧美检查互认协议 - 过去、现在与未来
2017.05.08
美国 FDA 将在今年 11 月根据美国/欧盟互认协议开始承认由某些欧盟成员国执行的制药设施检查,届时美国将完成对 8 个欧盟成员国检查机构的能力评估,到 2019 年 7 月之前完成对所有 28 个成员国的评估。欧盟将于今年 7 月完成对美国监管机构检查能力的评估。
FDA 全球监...
|

|
【课程】IPEM冻干技术专题课
2017.05.07
2017年6月26日 上海
2017年6月28-30日 北京
冻干工艺是一项提高药品稳定性、改善产品储存条件、延长产品效期和使用的关键工艺,广泛应用于药品和食品行业。许多原料药、制剂、尤其新的生物制剂常使用冻干技术作为主要的生产工艺。冻干技术的核心在于对冻干技术基本原理的深...
|

|
WHO将对癌症治疗生物类似药开展预认证试点
2017.05.05
为增加生物治疗药品的可及性,世界卫生组织(WHO)计划对其基本药品清单上的两个抗癌药相对应的生物类似药开展评估和预认证,这两个药分别为治疗非霍奇金淋巴瘤和慢性淋巴细胞白血病的利妥昔单抗(rituximab)和治疗乳腺癌的曲妥珠单抗(trastuzumab)。此外,WHO 还计划探索胰岛素预认证...
|

|
美患者团体和企业反对“Right To Try”联邦立法提案
2017.05.04
美国患者团体正在与国会议员一起修订“尝试权(Right To Try)”联邦立法提案,“尝试权”简单来讲就是要求赋予生命垂危患者在现有治疗无效时有尝试未获批上市的研究用药品的权利,禁止包括 FDA 在内的任何联邦机构采取任何行动限制对这类医药产品的制造、分销、处方、发放和使用的权...
|

|
美国本财年新拨款案,FDA预算授权略有增加
2017.05.02
美国 FDA 在 2017 财年新预算案中的非使用者付费拨款将增加,但 FDA 药品、生物制品和器械中心的预算仍会减少。
美国众议院和参议院拨款委员会于 4 月 30 日就 2017 财年综合拨款法案达成协议,该法案将为联邦政府提供截止到九月底的财政资金,并防止可能的政府关闭。同时...
|

|
美国仿制药提交趋势及成因一瞥
2017.05.01
当我们看到提交到美国 FDA 仿制药办公室(OGD)的 ANDA 数量时,有人可能会说,这怎么可能?在仿制药市场上有着如此多的并购活动,有些人认为这可能会导致提交量减少或至少有所下降,但事实并非如此。
【FDA 2017财年3月ANDA提交量激增的猜想 - 识林资讯 2017/04/30】
当我们回顾...
|

|
FDA 2017财年3月ANDA提交量激增的猜想
2017.04.30
美国 FDA 3 月份仿制药申请提交量再次飙升,共收到 197 件 ANDA 申请,比 1 月和 2 月的提交量显著增加(这两个月每个月的提交量都不到 60 件)。这是自 2012 年 10 月 仿制药使用者付费(GDUFA)计划推出以来提交量第 4 高的月份。
提交量剧增的原因似乎难以捉摸。这...
|

|
MHRA检查缺陷数据趋势及对企业内审的思考
2017.04.28
英国药品和医疗保健产品监管机构(MHRA)于 4 月 18 日公布了一份 2016 年检查缺陷数据趋势报告,希望企业作为自查和持续改进的一部分,能够对照缺陷发现开展自评。与 2015 年相比,MHRA 检查次数从 303 次增长到 324 次,海外检查从 79 次增长到 82 次。缺陷被分为 10 个...
|

|
【更新提示】药政信息摘要2017.04
2017.04.28
【CDE】 拟纳入优先审评程序药品注册申请的公示(第十六批)(04.28)
【CFDA】关于发布仿制药参比制剂目录(第三批)的通告(04.28)
【CFDA】关于发布仿制药参比制剂目录(第四批)的通告(04.28)
【CFDA】总局办公厅公开征求化学仿制药口服固体制剂一...
|

|
对已获批产品元素杂质要求的实施建议
2017.04.25
随着对于已获批产品的元素杂质要求实施日期的临近,尚未开始风险评估以使现有药品符合国际协调理事会(ICH)Q3D 元素杂质指导原则要求的企业最好现在就开始行动。
百时美施贵宝(BMS)公司分析化学家 Nancy Lewen 于 3 月 23 日在第三届 FDA/PQRI 促进产品质量年会上对于已...
|
|
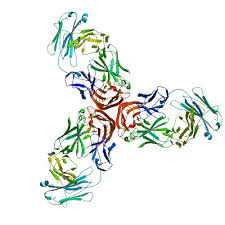
FDA 批准第二款英利昔单抗生物类似药Renflexis
2017.04.24
三星 Bioepis 公司的 Renflexis(infliximab-abda)于 4 月 21 日获得美国 FDA 批准,成为第五个在美国获得许可的生物类似药,同时占了几个第一的头衔。Renflexis 是 FDA 未经过咨询委员会审查的第一个生物类似药,还是在美国市场首次出现一个新生物制品(Janssen 公司的 TNF-抑制...
|

|
“器官芯片”技术:FDA开创性检测科学
2017.04.22
(译自FDA Voice https//blogs.fda.gov/fdavoice/index.php/2017/04/organs-on-chips-technology-fda-testing-groundbreaking-science/ “‘Organs-on-Chips’ Technology FDA Testing Groundbreaking Science” 2017 年 4 月 11 日,作者:Suzanne Fitzpatr...
|

|
EMA-FDA QbD 联合试点项目发布最终报告
2017.04.21
欧洲药品管理局(EMA)和美国食品药品管理局(FDA)完成了评估包含质量源于设计(QbD)元素的药品申请的联合试点项目,并于 4 月 19 日发布最终报告。
背景
联合试点项目最初于 2011 年 3 月根据美国-欧盟保密协定启动,初始定为三年,在 2014 年第一阶段完成后,双方同意...
|

|
澳大利亚药监局发布关于数据可靠性的政策声明
2017.04.20
跟随世界许多药品监管机构的领导,澳大利亚药品管理局(TGA)于 4 月 6 日发布了一份数据管理和
数据可靠性(DMDI)政策声明。TGA 指出,该政策“用于对 TGA 关于 DMDI 行业实践的官方立场提供一些澄清,”但同时指出,“数据管理和数据可靠性的要求并不是新的,早已在几十年前存在...
|

|
美国会发布FDA企业付费重授权立法首次讨论稿
2017.04.19
美国参众两院发布了使用者付费重新授权立法的讨论草案,草案非常简洁,并不包括对 FDA 的任何额外的政策或实践变化,但可能并不会就这么顺利结束。
首次讨论草案原文
讨论草案逐节总结
众议院能源与商务委员会和参议院健康、教育、劳工和养老金(HELP)委员会于 4 月 14 日联合发...
|

|
505(b)(2)申请比新分子实体申请需要更长审评时间
2017.04.18
根据 Tufts 药品研发研究中心(CSDD)与 Sakai 监管咨询公司的分析,美国 FDA 的 505(b)(2) 新药申请(NDA)路径 — 一种最常用于现有药品的新剂型和新配方的简化程序,并不会缩短审评时间。
2017 年 3 月/4 月的 Tufts CSDD 影响报告建议,虽然 505(b)(2) 路...
|

|
EMA发布胃肠道局部用药BE决策树
2017.04.17
2017年4月4日,EMA发布了一篇针对胃肠道系统局部用药的等效性研究指导原则,有4个章节分别介绍口腔/咽喉、胃、肠、直肠局部用药;明确了豁免临床试验的情况、如何进行体内生物等效性。
指导原则的名称为:胃肠道系统局部作用产品的治疗等效性证明的等效性研究指南草案,含已知成分的局...
|

|
国际药物工程管理(IPEM)课程教育班5月课程预告
2017.04.16
产业化方向
课程一:质量管理体系
授课老师:Blair Okita
授课方式:中英文交传
上课日期:4 月 27 - 28 日
老师简介:
Blair Okita 博士现任 Merck 全球生物制药质量高级副总裁,负责 Merck 生物制药部门制造和销售的所有药品和医疗器械产品(商业化和临床...
|

|
2017卓越运营研讨会
2017.04.15
北京大学国际药物工程管理(IPEM)项目与瑞士St. Gallen大学技术管理研究院合作举办第三届药业卓越运营(OPEX)研讨会,本次研讨会将特别介绍St. Gallen大学参与的美国FDA质量量度基金项目和QC实验室标杆研究,包含案例和讨论,欢迎企业管理者、生产管理者和OPEX负责人及其他相关人士...
|

|
GDUFA II 期年度项目费估算
2017.04.14
美国 FDA 于 4 月 11 日公布了正在收集的已获批申请持有人的现有数据,这些数据可以供我们估算三个层级的项目费(program fee)金额。虽然根据我们过去所做的大概估算来看并没有太出乎意料,但预估的收费标准可能会令在中等和大企业层级的某些企业有些震惊。此外,有一张表列出了首次拥...
|