
|
识林常见问题与解答 2019 更新
2019.05.10
第一类 识林是啥?
1. 识林是软件还是数据库?和其它数据库有什么区别?
识林既是软件,也是数据库。与传统信息查询型资料数据库(例如:注册或市场信息)不同,识林是信息+知识+工具(软件)的学习型知识数据库,聚焦全球监管法规(药监局、FDA、EU、WHO、PICS、ICH)及产业...
|

|
加速审批药品的广告或将受到特殊监管
2019.05.09
【编者按】药品作为一种特殊商品,经批准的标签/说明书是其特殊性的关键部分,广告作为标签形式的一种,同样为 FDA 所监管。药品广告分为两类,一类是面向医疗卫生专业人员的广告,这类广告的受众有专业的知识和经验,而另一类则是直接面对消费者(DTC)的广告,这类广告的受众通常是...
|

|
印度仿制药获 FDA 批准数据一瞥
2019.05.08
昨日印度时报(the Times of India)商业版上刊登的一篇短小文章颇为有意思,或许能帮助大家从另一个角度更深入地了解仿制药业目前的形势,因为大家并不经常能看到这些统计数据。文章概述了印度制药公司获得的批准数量以及警告信数量。
印度时报文章中的数据是基于财政年度(请注意...
|

|
美国年度特别301报告强调中国和印度的假药问题
2019.05.07
美国贸易代表办公室于 4 月 25 日发布年度《特别 301 报告》,强调假药问题日益严重,并重点提及中国和印度。
《特别 301 报告》(Special 301 Report)是美国对其全世界贸易伙伴国的知识产权保护和执法状况的年度审查报告,由美国贸易代表办公室(USTR)按照美国《1974 年贸...
|

|
保密特权挑战 GMP 检查员查阅质量文件的权限
2019.05.06
美国食品药品和化妆品法(FDCA)给予 FDA 查阅制药公司 GMP 文件的权力。公司拒绝或阻碍此权利的实施可导致 GMP 违规,其生产的药品可被视为伪劣(adulterated) 产品,从而不被批准或被禁止销售。看似直截了当的事,但竟然有一家公司敢于挑战。去年 8 月,美国 Immunomedics 公...
|

|
【更新提示】识林一周回顾(20190428-0504)
2019.05.05
【IPEM】质量管理体系专题课5月上海开班(05.01)
5月23-24日,由周康平博士和罗瑞昌博士主讲药品全生命周期的质量管理(ICH Q10)。全面系统地讲解ICH Q10“制药质量体系”指南,阐释制药企业如何建立从药品研发、技术转移、商业化生产直至撤市的完整产品生命周期的质量管理体系。5月2...
|

|
FDA 药品中心主任再谈新药审批现代化
2019.05.04
美国 FDA 药品审评与研究中心(CDER)主任 Janet Woodcock 于 5 月 2 日在食品和药品法律研究所(FDLI)年会上再次重点介绍了新药审批改革举措,表示 FDA 将在未来两年内实现以现代化的方法审评新药申请(NDA)和生物制品许可申请(BLA)。这已经不是 Woodcock 第一次谈论这一议...
|

|
欧盟发布 2006-2018 检查和缺陷趋势概况文件
2019.05.03
欧洲药品质量管理局(EDQM)于 4 月 30 日发布《EDQM 检查和缺陷趋势:2006-2018 概况》文件,回顾了 EDQM 在 2006 年至 2018 年间开展的 API 检查数据。文件虽仅有 10 页但干货满满,有各种图表给人以直观感觉,识林对文件全文做了翻译,供大家阅读。
1) 介绍
...
|

|
FDA 推出新网页预告复杂产品 BE 指南的发布
2019.05.02
美国 FDA 昨天推出了新的网页“即将颁布的针对复杂药品研发的具体产品指南”。新网页提供了有关 FDA 在未来一年内针对复杂产品计划发布的新的或修订具体产品指南(product-specific guidances,PSG)。FDA 表示,该网页上的信息将有助于仿制药公司更好地规划复杂仿制药的开发。
背景...
|

|
欧盟无菌附录修订草案目检要求变化解读
2019.05.01
制药商应加强目检计划,以符合欧盟 GMP 附录 1 修订版中有关目视检测非肠道药物缺陷的更严格标准。修订版草案澄清了需要目检的容器类型,并要求除目检之外使用自动化方法来捕获产品缺陷。
Insight Pharma 咨询公司的首席顾问 John Shabushnig 于 4 月 23 日在美国华盛顿举行...
|

|
FDA 推迟组合产品安全报告的合规执法日期
2019.04.30
美国 FDA 于 4 月 23 日发布即时生效的指南文件《组合产品上市后安全报告(PMSR)合规政策》,宣布将对 2016 年 12 月 20 日发布的组合产品上市后安全报告最终法规中规定的某些安全报告要求行使执法自由裁量权(Enforcement Discretion),并将这一行动编入法案 21 CFR 第 ...
|
|
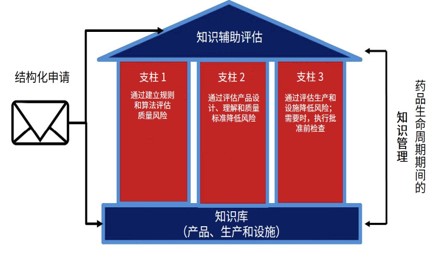
KASA — 面向21世纪的药品评价模式
2019.04.29
两周前在美国马里兰举行的PQRI大会上,FDA药品质量办公室副主任余煊强博士正式向业界宣布了面向21世纪的FDA药品评价(assessment*)新倡议:KASA(Knowledge-aided Assessment and Structured Application,之前翻译为知识辅助评价和结构化申请,余煊强博士建议翻译为智能评价和结构...
|

|
【更新提示】识林一周回顾(20190421-0427)
2019.04.28
【识林】线下交流会 — 专利保护的新形势和制药产业的应对策略(04.22)
5月11日下午230-500,现任中国国家知识产权局化学发明审查部审查业务处处长,专利审查研究员刘桂明先生就药品专利主题与大家进行交流,内容包括中国建立药品专利链接和药品专利期限补偿制度的背景,美国药品专...
|

|
IPEM 美国仿制药研发课堂问答一瞥
2019.04.27
时间:4月11日至14日
地点:IPEM课程 — FDA仿制药法规与产品研发的课堂上
人物:Garth Boehm博士和IPEM学员
学员 1:老师,与原研的处方相比,仿制药的处方有没有可以接受的波动范围?例如,原研API为10g,仿制药API的含量波动范围是95-105%,两者处方没有达到100...
|

|
PICS 数据可靠性指南修订稿有哪些重点变化?
2019.04.26
去年年底,国际药品认证合作组织(PIC/S)和美国 FDA 分别更新了其数据可靠性指南,关于 FDA 数据可靠性定稿指南的亮点与变化,我们之前曾专门发布两篇资讯来介绍:【FDA 数据可靠性问答定稿指南中值得注意的变化 2018/12/14】,【FDA 数据可靠性指南 — 亮点与观察 2019/01/...
|

|
英国监管机构对 GDP 场地试点远程检查计划
2019.04.25
英国药品与医疗保健产品监管机构(MHRA)于 4 月 16 日在其官方博客上宣布计划测试一种新方法,通过远程、非现场检查(office-based inspection)和风险评估,来检查企业对于药品经营质量管理规范(GDP)的符合性。MHRA 表示启动非现场评估和风险评价(Office Based Evaluation and Ris...
|

|
工业界要求 FDA 进一步澄清竞争性仿制药指南草案
2019.04.24
辉瑞、Perrigo、Teva、Apotex 等公司以及美国普享药协会(AAM)都要求美国 FDA 对竞争性仿制药(CGT)认定和 CGT 专营权指南草案做出进一步澄清。
CGT 认定旨在激励企业开发仅有很少或没有竞争的药品的仿制药。到目前为止,FDA 已经许可了超过 100 多份 CGT 认定请求,并于 201...
|

|
增长乏力,IBM 停售用于药物发现的 AI 工具
2019.04.23
据消息人士称,由于财务业绩低迷,IBM 正在停止开发和销售另一人工智能(AI)产品,该产品可以使用其 Watson 人工智能软件来帮助制药公司发现新药。
停售 Watson for Drug Discovery(Watson 药物发现)的决定标志着该公司在多个医疗领域应用人工智能努力的最大溃败。去年,IBM...
|

|
ICH 公开寻求非营利机构的培训合作
2019.04.22
为加快指南的全球实施,ICH 发出呼吁,希望经认可的非营利性组织向监管机构提供 ICH 指南培训。
全球制药商和主要工业化国家于 1990 年组建了 ICH,以协调全球监管方法,现在欠发达国家正在努力希望自己能够达到统一的监管方法,但这些国家的监管机构急需培训。ICH 希望与一个或...
|

|
【更新提示】识林一周回顾(20190414-0420)
2019.04.21
【FDA】指南草案 双特异性抗体研发项目行业指南(04.19) 资讯
指南为参与双特异性抗体开发的人员提供了建议,讨论包括双特异性抗体开发计划的一般考虑和建议,以及双特异性抗体开发计划背景下的法规,质量,非临床和临床考虑因素,例如,在该部分,指南草案指出,FDA 可能要求“将双...
|