
|
FDA 发布生物制品 CMC 批准后变更定稿指南
2021.06.23
美国 FDA 于 6 月 21 日发布了《已获批生物制品申请的 CMC 变更》定稿指南,帮助生物制品制造商确定其产品哪些类型的变更应在年报中提交,哪些需要提交需事先批准的补充申请(PAS)。
该指南的草案版本于 2017 年 12 月发布,定稿指南对草案做了一些细微的更改。指南涵盖的...
|
|
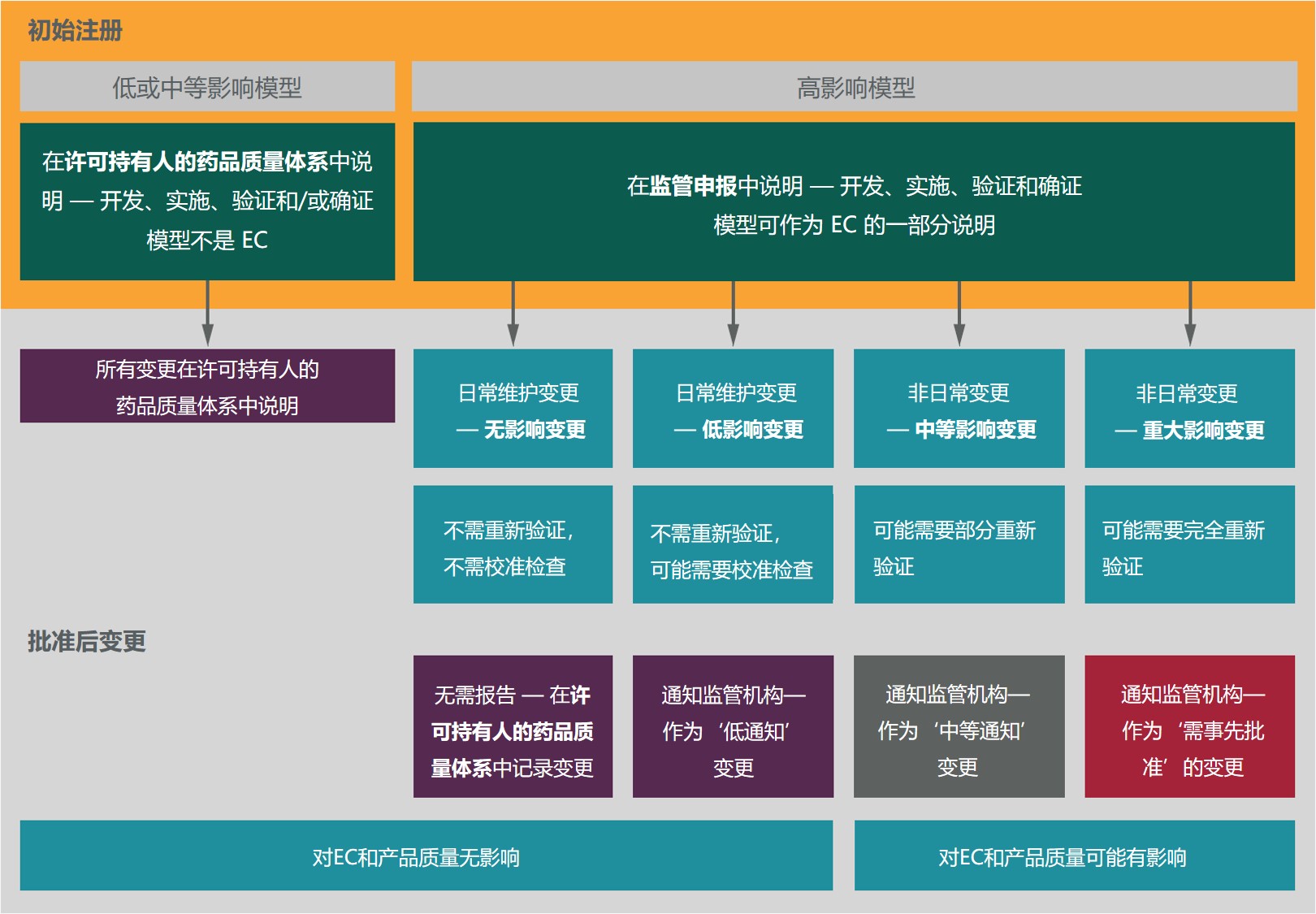
行业组织建议 ICH 降低对制造模型的监管监督,以期...
2021.05.27
最近几个行业组织共同制定了一项提案,用于管理对制药生产过程中使用的模型的监管监督,提出即使对于那些对药品生产有重大影响的模型也可以放松监管使用次要变更途径。
这几个行业组织分别是:BioPhorum、国际药物开发创新和质量联盟(IQ 联盟)以及制药过程分析圆桌会议(PPAR)。他...
|

|
全球批准后变更所面临的挑战和解决方案
2021.05.24
药品批准后变更全球协调是制药企业尤其是有产品在多个国家/地区申报上市的企业关心的主要问题之一。Intarcia 工厂负责人兼全球质量副总裁 Anders Vinther 在 2 月份举行的 DIA 拉丁美洲监管会议上,介绍了有关“统一的质量声音(One Voice of Quality, 1VQ)”组织对于批准...
|

|
FDA 发布疫情期间玻璃瓶和胶塞的变更指南
2021.03.05
美国 FDA 于 3 月 4 日发布了题为《COVID-19 容器密封系统和组件变更:玻璃瓶和胶塞》的指南,向制药商传达有关报告和实施对包括玻璃瓶和胶塞的容器密封系统(CCS)组件的一些常见变更的建议。
FDA 认识到在 COVID-19 公共卫生紧急情况下,由于供应链问题影响的可用性,某...
|

|
FDA 仿制药批准后变更补充申请降级,变更审批加速
2020.07.30
美国 FDA 正在加快审评因 COVID-19 的影响而迫切需要的简化新药申请(ANDA)批准后生产变更补充申请。在这些加快的批准后补充申请中常见的变更涉及:生产场地;生产工艺调整;批量大小(例如,放大);容器密封系统;分析方法;原料药/辅料的供应商;以及质量标准等。
在某些情况下...
|

|
哪些变更需要立卷审查 — FDA 修订审评程序手册
2020.04.21
美国 FDA 于 4 月 17 日发布对《MAPP 5200.7 由立卷审查处审核 ANDA 增补和补充申请》的第1版修订,在这份 MAPP 中,FDA 解释了其在包含变更的待审 ANDA 的增补或已批准申请的补充申请方面的决策过程,工作程序和职责。
需要立卷审查的变更包括:
新规格(即,除 AN...
|

|
生产变更如何选择最佳监管路径
2020.04.13
对于已获批药品,变更是不可避免且一直存在的,并需要向监管部门报告。本文分别讨论在新药申请(NDA)或简化新药申请(ANDA)批准下变更的挑战,以及有关变更报告的思考。
最近,在普享药协会(AAM)的一次会议上,来自FDA仿制药办公室的发言者介绍指出,提交到ANDA的批准后补充申请的...
|

|
PICS 发布评估与变更管理相关的质量体系有效性的建议
2019.11.30
国际认证合作组织(PIC/S)于 11 月 29 日发布《关于如何评估/证明药品质量体系在基于风险的变更管理方面的有效性建议》,为 GMP 检查员在评估企业与基于风险的变更管理相关的药品质量体系(PQS)的有效性时提供了实用指导。建议涵盖了变更管理过程中的所有相关步骤:变更提议,变...
|

|
FDA寻求权力扩张:监管上市后质量变更和公开讨论申报...
2019.04.11
美国 FDA 希望能够在产品批准后要求申办人开展特定变更或质量更新,以确保之前发现的质量问题得到解决。FDA 在 2020 财年预算解释文件中,将该问题作为其立法提案的一部分明确提出。
FDA 在文件中指出,FDA 经常要求申办人“在批准后补充申请或报告中提供某些信息或研究,以解决...
|

|
缬沙坦危机引发 FDA 着手修订 GMP
2019.03.26
美国 FDA 局长 Scott Gottlieb 于 3 月 19 日在布鲁金斯学会上透露,FDA 正在准备改写药品 GMP 法规的部分内容来加强对原料药(API)生产工艺变更的监督。根据 FDA 正在起草的对 GMP 法规的修订,制药商必须向 FDA 报告有关对于原料药生产工艺计划变更的更多信息。
...
|

|
FDA 启动有关药品质量的“既定条件”试点计划
2019.02.19
美国 FDA 于 2 月 14 日宣布了一项新的试点计划,以测试在药品申请质量评估中的“既定条件(Established Conditions,EC)”概念。该试点的目的是让 FDA 在评估拟议既定条件方面获得实践经验,并确保评估决策不会对使用者付费时间框架产生负面影响。EC 是“为保证获批产品的工艺...
|

|
FDA 发布原料药批准后变更指南草案
2018.09.11
美国 FDA 于 9 月 10 日发布《原料药批准后变更》指南草案为打算在成品药申请批准后阶段变更原料药生产过程的制药商提供了指导意见。
作为仿制药使用者付费修正案(GDUFA II)重授权的一部分,FDA 承诺发布有关 API DMF(也称为 II 类 DMF)批准后变更的指南,以及引用该 DM...
|

|
FDA 与业界对 ICH Q12 中基于性能的已建立的条件...
2018.02.22
制药行业人员对于在国际协调理事会(ICH)关于批准后变更的 Q12 指南中列入基于性能(performance-based )的已建立的条件(established conditions,EC)表示支持。这种方法使制造商在对已获批产品做生命周期生产变更时有更大灵活性,而无需事先获批监管机构的批准。
美国 FDA ...
|

|
FDA 表示生物类似药批准后变更指南即将发布
2017.09.25
美国 FDA 打算很快向生物类似药申办人提供有关批准后变更期望的更多信息,但不是在独立的指南文件中提供。似乎 FDA 可能不会在现有的确保变更是可接受的 ICH 指南之外做出额外要求。
在最近普享药协会(AAM)关于生物类似药的会议上,Sandoz 公司人员询问,申办人是否应对生物类...
|

|
FDA 阐述可通过年报记录的生物制品生产变更
2017.08.13
为减少不必要的补充申请提交数量,FDA 正在寻求澄清哪些类型的生物制品生产变更是微小的,并且可以在年报中提交。为帮助澄清这一问题,FDA 于 8 月 8 日发布了题为《年报记录指定生物制品的 CMC 批准后生产变更》指南草案。FDA 表示,需要做出这方面的澄清,以减少工作量并消除不...
|

|
FDA-PQRI会议上报告的ICH Q12 进展更新
2017.03.26
3 月 22 - 24 日第三届 FDA/PQRI 先进产品质量会议在华盛顿召开,来自监管机构、企业、大学、行业协会和咨询机构共约200余人参会。会议重点话题之一就是 ICH Q12 《药品生命周期管理的技术和监管考虑》指南的进展以及在技术和监管上的全球协调统一情况。
葛兰素史克全球 CMC 战略...
|

|
原料药供应来源的变化能否通过可比性协议向FDA提交
2016.10.26
多年来我一直在努力说服企业,对于已获批ANDA的某些变更必须始终作为之前已获批申请的补充申请(PAS)提交,或者在某些情况下,这些变更可以作为在ANDA中已获批的可比性协议处理。在美国仿制药协会(GPhA)2016秋季技术会议上,FDA药品审评与研究中心(CDER)药品质量办公室(OPQ)检验和...
|

|
FDA更新批准后CMC变更指南
2016.04.23
4月19日FDA发布《人用药和生物制品可比性协议:化学、生产和控制信息行业指南》修订草案。修订草案给药品制造商提供了通过使用可比性协议(CP)实施CMC批准后变更的建议。FDA表示,属于该指南草案范围内的企业在做拟定变更之前将不需要向FDA递交关于批准后产品商业规模的CMC信息。
修订...
|

|
阐明EC能否重构企业上市后变更之路
2016.01.25
2015年10月,ICH Q12 专家工作组(Expert Working Group,EWP)召开新一轮会议,探讨“已建立的条件”(Established Conditions,EC) 与 ICH Q12 在全球生命周期管理中应起到的作用。对于“已建立的条件”这一术语,尚无权威的中译。US FDA 曾在2015年发布过一篇名为 Established Con...
|

|
关于批准后变更的监管,FDA定义了“已建立的条件”
2015.07.02
2015年5月29日,FDA发布了指南草案《已建立的条件: 已获批的药品、生物制品需要报告的CMC变更》(Established Conditions Reportable CMC Changes for Approved Drug and Biologic Products)。定义了术语:已建立的条件(Established Conditions,EC)。
FDA没有使用美国...
|