
|
欧盟永久化学品禁令临近,全球药包材行业准备应对
2025.02.21
欧盟针对"永久化学品"PFAS(全氟和多氟烷基物质)的全面禁令进入立法最后阶段,药品包装供应链正面临严峻挑战。最新企业财报与分析师报告显示,这场监管风暴已引发跨国药企、包材制造商及投资者的普遍焦虑。
根据 2023 年 2 月提案,欧盟拟禁止所有 PFAS 类物质的使用。PFAS ...
|

|
欧盟拟起草模型引导药物开发(MIDD)新指南
2025.02.18
欧洲药品管理局(EMA)于 2 月 14 日发布了一份“关于制定模型引导的药物研发中机制模型的评估与报告指南的概念性文件”,以鼓励新机制模型在模型引导的药物开发(MIDD)中得到更广泛的使用。指南预计在 2026 年完成草案制定,目前正在寻求其它监管机构意见,意见截止日期为 2025 年...
|

|
欧盟修订思考性文件,概述动物测试的替代方法
2025.02.18
欧洲药品管理局(EMA)于 2 月 13 日发布了题为“当前人用药监管检测要求和实施 3R(替代、减少、优化)机会”的思考性文件,系统梳理了制药商可用的非动物替代测试方法,旨在推动减少、优化和替代药物研发中的动物试验。
该文件是对 2018 年版本的重大更新,并与国际 3R 原则行...
|

|
欧盟发布非致突变杂质思考性文件
2025.02.11
欧洲药品管理局(EMA)于 1 月 30 日发布了《非致突变杂质资格界定的思考性文件》(草案),提出通过整合现有毒理学数据、交叉参照(Read-Across)、计算毒理学及体外方法等替代策略,减少对动物实验的依赖,加速药品杂质安全评估。
文件重点关注化学合成药物中的非致突变杂质。EM...
|

|
欧盟 2024 年推荐药物批准量创 15 年来新高
2025.01.20
欧洲药品管理局(EMA)于1 月 16 日发布《2024 年人用药》报告,总结了其人用药委员会在 2024 年的行动情况:共推荐批准 114 个新药,其中 46 个是含有新活性成分的药品。这是 15 年来发布推荐批准意见数量最多的一年。
EMA 首席医疗官表示,癌症仍然是 2024 年获得...
|

|
欧盟修订上市许可申请数据透明度指南
2024.12.20
欧洲药品管理局(EMA)和成员国药品管理首脑机构(HMA)于 12 月 18 日公布了一份修订指南,旨在创建用于识别人用药上市许可申请(MAA)中的商业机密信息(CCI)和个人数据的一致方法。
距离 2012 年发布初始指南已有十多年,此次修订代表了监管机构对这一领域的指导方针的“全面...
|

|
EMA 局长总结 2024 年药品监管工作
2024.12.19
欧洲药品管理局(EMA)局长 Emer Cooke 撰文总结了2024 年 EMA 在药品监管方面的工作成绩。她整体认为“2024 年的特点是高效、稳定的创新和监管网络内不可动摇的协作。”
2024 年 EMA 推荐了 114 个人用新药,其中 48 个含有全新的活性成分,16 个用于治疗罕见病。这是自 20...
|
|
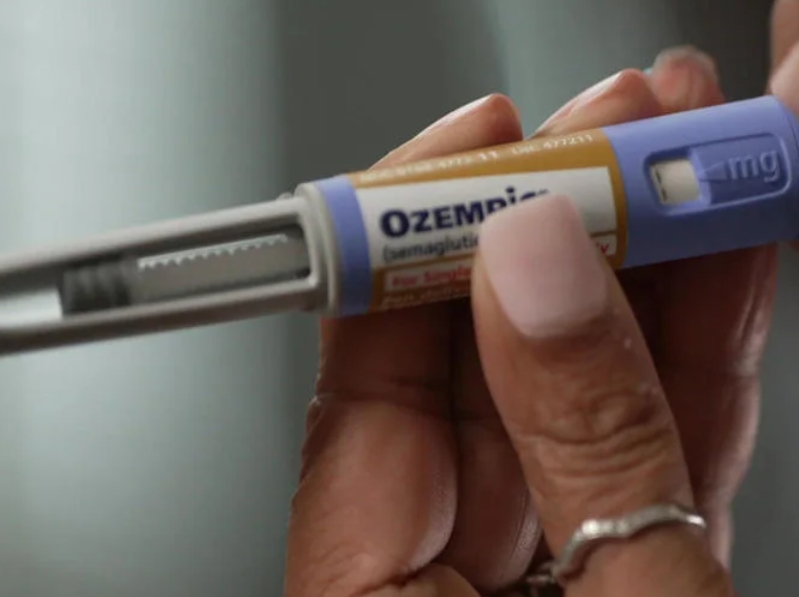
欧盟计划对司美格鲁肽与罕见眼部疾病之间的联系开展调...
2024.12.19
据路透社报道,南丹麦大学(SDU)最近发布的两项独立研究表明,使用 Ozempic(司美格鲁肽)会增加患者患上罕见眼部疾病的几率,欧盟决定展开调查。
这一决定是在丹麦药品管理局(DMA)要求欧洲药品管理局(EMA)的药物警戒风险评估委员会审查这些信息后做出的。
截至 12 月 10 日...
|
|
欧盟发布药品短缺缓解和预防计划指南
2024.12.11
欧洲药品管理局(EMA)和成员国药品管理首脑机构(HMA)于 12 月 9 日发布了两项指南,提供了有关制药商应如何实施短缺缓解计划(Shortage Mitigation Plans,SMP)和短缺预防计划(Shortage Prevention Plans,SPP)的更详细信息。
关于药品短缺问题最近的相关举措还包括,11 月...
|

|
欧盟就儿童体重控制临床试验监管征求反馈意见
2024.12.06
欧洲药品管理局(EMA)于 12 月 3 日公布了一份关于儿童体重控制药物临床评价指南的概念文件草案,就修订儿童体重控制现有附录征求意见。
EMA 于 2008 年通过了现有的儿童体重控制附录。2016 年,EMA 修订了用于体重控制的药物临床评价的主要指南。现在,EMA 计划修改儿童体...
|

|
Teva 因诋毁竞争对手并利用专利阻碍竞争在欧盟被罚 ...
2024.11.01
世界上最大的仿制药生产商,总部位于以色列的 Teva 制药因涉嫌阻碍其多发性硬化症药物的竞争而被欧洲反垄断监管机构罚款 5.03 亿美元。
欧盟委员会调查发现 Teva 人为延长了其畅销多发性硬化症治疗药 Copaxone(醋酸格拉替雷)的专利保护,并系统的传播有关竞争对手产品的误导...
|

|
欧盟计划采取一系列措施提高药品审批流程效率
2024.10.04
欧洲药品管理局(EMA)于 10 月 2 日表示正在寻求加快药物审评时间表,简化审评流程,以进一步提高欧盟新药审评和批准流程的效率。
根据 EMA 最近发布的一份报告,EMA 从 2023 年开始监控每一份新的上市许可申请(marketing authorisation applications,MAA),以更好地了...
|

|
欧盟定稿基于单臂试验确立有效性的思考性文件
2024.09.25
欧洲药品管理局(EMA)于 9 月 16 日定稿了一份基于作为上市许可中的关键证据提交的单臂试验(single-arm trials,SAT)确立有效性的思考性文件。
EMA 于去年 4 月发布了该文件的草案版本以供征求意见。定稿文件保留了草案的重点和结构,但 EMA 根据收到的 45 条利益相关...
|

|
肝病治疗药 Ocaliva 在欧盟遭撤销许可,FDA 于本月...
2024.09.04
Advanz 药业于 9 月 3 日表示,欧盟委员会已撤销了其肝病治疗药 Ocaliva(奥贝胆酸)的有条件上市许可。Ocaliva 在欧洲作为原发性胆汁性胆管炎(primary biliary cholangitis,PBC)患者的二线治疗药物上市,但欧洲药品管理局(EMA)人用药委员会于 6 月份重新评估了该药的获益...
|

|
欧盟更新化学和生物药剂的治疗和预防指南
2024.08.16
欧洲药品管理局(EMA)于 8 月 12 日发布了两份更新指南,分别针对治疗或预防因接触可能被用作恐怖主义武器的生物或化学药剂的药物。
在制定指南的过程中,EMA 的紧急工作组(Emergency Task Force,ETF)咨询了 50 多位专家的意见,这些专家来自毒理学、药理学、临床管理和军...
|

|
欧盟发布制定鼻用产品治疗等效性指南的概念文件
2024.08.05
欧洲药品管理局(EMA)于 7 月 25 日发布了一份概念文件,提议制定新指南,旨在明确仿制药商在证明鼻用药品与参照产品治疗等效性(TE)时应提交的数据要求。
EMA 指出,鼻用药品在治疗普通感冒、过敏性鼻炎以及作为注射产品的替代品方面具有重要作用。证明治疗等效性的方法会根据...
|

|
欧盟发布医疗器械和体外诊断器械中使用人工智能的法规
2024.07.16
欧盟委员会(EC)发布了《人工智能法》(Artificial Intelligence Act,AIA)的最终版本,该法建立了促进在医疗器械、体外诊断器械(IVD)和其它产品中采用“以人为本且值得信赖”的人工智能(AI)的法律框架。根据欧洲议会称,该法还制定了将产品投放市场的统一规则,是世界上第一部全面...
|

|
欧盟委员会发布药品短缺试点研究技术报告
2024.07.15
欧盟委员会(EC)于 7 月 10 日公布了一份评估关键药物供应链漏洞的技术报告,以了解确保药品供应链安全的挑战。新冠疫情期间,欧盟成员国面临几次严重的药品短缺,促使欧盟委员会和其它利益相关者调查药品短缺的根本原因以及如何应对。2023 年 12 月,委员会、成员国药品管理首脑机构(...
|
|
首个慢阻肺治疗性生物制品 Dupixent 在欧洲获批
2024.07.04
十多年来,慢性阻塞性肺病(COPD)的治疗一直没有进展,但最近在一周内,美国和欧洲监管机构相继批准了两种用于治疗 COPD 的药物。
7 月 3 日,欧洲药品管理局(EMA)批准了赛诺菲和再生元的抗炎重磅药物 Dupixent(达必妥,Dupilumab)用于治疗 COPD。一周前,6 月 26 日,美国 F...
|

|
欧盟临床试验透明度进展更新
2024.06.27
欧盟更新的临床试验门户网站以及要求申办人在临床试验信息系统(Clinical Trial Information System,CTIS)中列出其试验信息的新透明度规定已于 6 月 18 日生效。根据新规,4000项临床试验的信息将公开可得。
欧洲药品管理局(EMA)临床试验转型工作负责人 Ana Zanoletty Pere 在...
|