
|
FDA 发布疫情期间仿制药研发和申报问答指南
2021.04.07
美国 FDA 于 4 月 5 日发布了针对仿制药生产商的新问答指南,以解决新冠(COVID-19)公共卫生紧急事件期间仿制药开发以及简化新药申请(ANDA)申报和评价相关问题。
FDA 表示,“FDA 认识到 COVID-19 公共卫生紧急事件可能会影响仿制药产品的开发,中断或延迟 ANDA 申请...
|
|
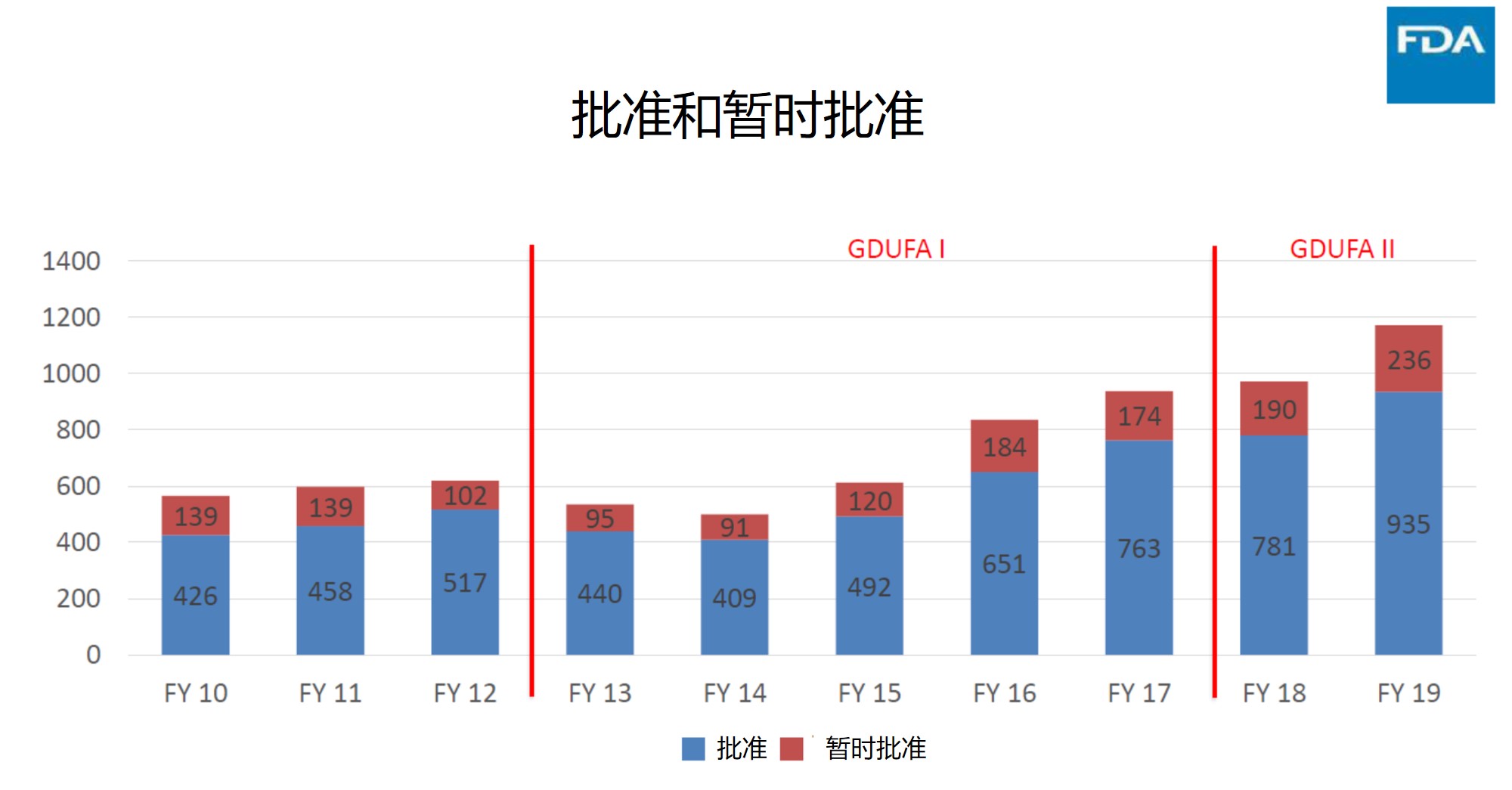
FDA 仿制药论坛上报告的一些审批数据及申报建议
2020.04.20
美国 FDA 于 4月15-16日举行了为期两天的仿制药论坛,会上有许多精彩话题,包括具体产品指南、仿制药办公室(OGD)标签审评和要求的介绍、简化新药申请(ANDA)与FDA的互动、电子提交、ANDA 计划绩效审查和改善 ANDA 质量的小贴士,以及根据行动函时间对一些申请的案例研究。另外还...
|

|
FDA 修订了仿制药申请审评优先级政策 20200130
2020.01.30
FDA revises generic drug application prioritization policy to ensure fairness to applicants, efficiently allocate limited agency resources, and protect the public health
Today, the U.S. Food and Drug Administration published a revision to Manual of ...
|

|
FDA 重要更新:ANDA 行动函转为仅电子邮件发送
2019.10.03
美国 FDA 于 10 月 1 日通过邮件通知表示,从本月起,拥有安全电子邮件账户的简化新药申请(ANDA)申请人将仅通过安全电子通讯收到行动函(包括:批准、暂时批准、完全回应函),因为 FDA,包括仿制药办公室(OGD)在内正在持续努力摆脱纸质通讯。
为帮助确保及时收到 FDA OGD...
|

|
ANDA申报流程及材料清单上线了
2018.08.29
自片剂工艺验证流程以来,识林陆续梳理了胶囊剂工艺验证流程、美国FDA DMF申报流程、EDQM-CEP申报流程等场景应用工具,且每个流程的关键步骤都配有参考资料清单,申报资料的编写也做了详细总结。
场景应用工具上线后,用户好评并积极反馈,也有更多专业人士进入识林“植树”,识林...
|

|
FDA PIV 清单更新四项专利挑战
2018.03.31
申请仿制药的每个人都知道,在专利期满之前公司想要仿制药上市必须挑战现有专利(称为第四段专利挑战PIV)。FDA更新其PIV申请清单,以便其他公司知道第一个申请人的申请日期。FDA开始发布PIV申请清单,以提醒公司已经有实质完整的申请提交和提交日期。清单列表并没有说明申请人是谁,...
|

|
2017年中国药企获FDA批准的ANDA国内同步申报情况
2018.03.29
获得美国FDA的认可对中国药企的国际化战略至关重要。2017年,美国FDA批准了中国药企的41个ANDA。
获得FDA批准和暂时批准的中国药企,按数量排名:华海药业(10个)、石药集团CSPC(6个;备注:阿奇霉素片的3个规格按照1个ANDA计算)、江苏恒瑞(5个;备注:多西他赛注射液的2个规...
|

|
仿制药还是505(b)(2)申请?FDA 给出建议
2017.10.12
美国 FDA 于 10 月 12 日发布业界期待已久的《行业指南:决定提交 ANDA 还是 505(b)(2)申请》草案。我希望这份指南能够在企业选择遵循的监管提交路径方面提供一些新的洞察,然而对于那些可能不熟悉 Hatch-Waxman 法案复杂性的人来说,这是一份很好的入门指导,而对于我们...
|

|
美国仿制药提交趋势及成因一瞥
2017.05.01
当我们看到提交到美国 FDA 仿制药办公室(OGD)的 ANDA 数量时,有人可能会说,这怎么可能?在仿制药市场上有着如此多的并购活动,有些人认为这可能会导致提交量减少或至少有所下降,但事实并非如此。
【FDA 2017财年3月ANDA提交量激增的猜想 - 识林资讯 2017/04/30】
当我们回顾...
|

|
提交日期重新出现在FDA批准函中
2017.04.04
自我有记忆以来,ANDA 的提交日期就在申请的批准函中报告。但这一做法在 2016 年初终止了。申请的提交日期是帮助企业跟踪申请批准时间的重要指标。当申请提交日期在批准函中消失时,我们听到了许多企业的抱怨。仿制药贸易协会甚至提出这一做法使得仿制药计划进一步缺乏透明性。【ANDA批...
|

|
FDA发布ANDA和505(b)(2)申请最终规定
2016.10.09
FDA于10月6日在联邦公报(FR)公布了一项实施《2003医疗处方药、改善和现代化法案(MMA)》第XI篇的最终规定(Abbreviated New Drug Applications and 505(b)(2) Applications)。FDA自2003年起一直根据MMA第XI篇的法规条款监管,而现在(根据各种法院判决和FDA经验)在法案通过1...
|

|
7月仿制药计划行动报告更新
2016.08.31
虽然在更新数据方面没有太多新的数据或趋势,但很显然美国FDA仿制药办公室(OGD)正在发布更多完全回应函(CRL)。OGD 7月份发布169封CRL,成为2016财年次高的月份(4月份最高190封)。这些数字也比过去几年显著更高。
Activities Report of the Generic Drug Program (FY 201...
|
|
缺乏杂质限度依据可能导致ANDA拒收
2016.08.25
8月24日,FDA重新发布《ANDA提交 — 缺乏杂质限度依据的拒绝接收》行业指南,替代了之前于2014年9月发布的《ANDA提交 — 缺乏杂质限度适当依据的拒绝接收》行业指南草案,标题中删除了“适当”一词。FDA在联邦公告通报中解释指出,“在审查了对指南草案提交的评议之后,FDA将‘适当’...
|

|
FDA Para IV 清单更新四个产品
2016.06.26
6月21日仿制药办公室(OGD)更新了第IV段声明数据库(Paragraph IV数据库,PIVDB)pdf。该数据库列出了首次提交并取得第IV段声明的产品,即ANDA所根据的参照产品的至少一个专利在其ANDA递交中不被侵犯或无效或无法执行。这一数据库旨在为预期的ANDA申请人提供专利保护品种的第一份ANDA何...
|

|
ANDA批准函中的提交日期消失
2016.04.02
大约一周前,我开始收到关于仿制药办公室(OGD)批准信格式变化的电话和反馈。最初可能是一个微小变化,令许多企业感到不满,同时也代表了另一个没有警告或不加解释而发生的“透明性”过失。以下是来自2封ANDA批准函开头的句子。阅读这两句话,请看在示例B中缺少了什么。
示例A
This ...
|

|
FDA发布合并ANDA申请号的指导性文件
2015.10.28
10月26日,FDA的仿制药办公室(OGD)发布了一份政策和程序手册(MAPP)文件,题目为《仿制药办公室的ANDA合并》(Consolidation of ANDAs by the Office of Generic Drugs)。本MAPP描述的不是新事情,但是新确定了相同厂家、不同规格、同一药品的多个ANDA申请号合并为一个ANDA申...
|
|
改剂型、改规格的ANDA在USFDA的申报途径
2015.08.07
改剂型、改规格的ANDA在USFDA的申报途径
FD&CA 505
(j) Abbreviated new drug applications
(2)(A) An abbreviated application for a new drug shall contain—
(iii) information to show that the route of administration, the dosage form, and the str...
|

|
美国FDA就丧失180天专营期的ANDA个例征求意见
2015.08.01
7月28日,FDA在Regulations.gov 发布了“致申请人之信”(Dear Applicant Letter 相关的两个有趣的问题向相关方征求意见。
p1=案件:
参照药品(RLD)是环孢霉素滴眼液, 0.05% ,商品名为Restasis。参照药品Restasis是Allergan公司在2002年3月获得FDA批准的。Restasis的第一...
|

|
FDA仿制药申请积压历史回顾
2015.07.17
仿制药办公室(OGD)的积压问题已有多久的历史?ANDA的审评和批准过程的本质就保证了会一直有积压。因为企业在现有基础上递交申请,OGD花时间审评和评估每件申请。OGD成功的关键是保持积压在一个可控的水平。
1984年Hatch Waxman法案通过时,大批ANDA申请涌入。OGD(当时还是仿制药处...
|

|
OGD计划在处方相似性审评中隐藏更多信息
2015.05.24
某些特定的仿制药在同原研比对时,保证原料药和辅料成分“定性(Q1,qualitatively)定量(Q2,quantitatively)”相一致,可避免再进行体内药代动力学研究,或者基于临床终点的生物等效性试验。仿制药办公室过去允许企业针对特定品种(例如,滴眼液、部分外用产品以及某些液体制剂),提...
|