
|
EMA 推出亚硝胺杂质短中长期完整实施计划
2020.10.30
欧洲药品管理局(EMA)推出了完整实施计划,以减少药物被亚硝胺杂质污染的风险,并确定了短期、中期和长期的工作重点。
实施计划建立了一个框架,用于落实 2020 年 6 月 EMA 发布的《从沙坦类药物出现亚硝胺杂质事件学到的经验教训》报告的具体建议。【欧盟报告全面总结沙坦类药...
|

|
EMA 新负责人:用得到且买得起的药才是有价值的药
2020.10.29
即将出任欧洲药品管理局(EMA)新负责人的 Emer Cooke 表示,“无论是基本药物还是创新药,如果不能用到患者或动物身上,那么都毫无价值。”
在 EMA 举办的庆祝成立 25 周年的网络会议上,Emer Cooke 任命后首次公开露面时讲话表示,“随着越来越多的复杂药物进入市场,我们需...
|

|
欧盟发布老年人药品开发考虑因素,鼓励以患者为中心的...
2020.10.27
欧洲药品管理局(EMA) 10 月 15 日发布了一份思考性文件,敦促制药商在开发药品时考虑 65 岁及以上老年患者的身体和认知能力,涵盖的考虑因素涉及选择适当的给药途径和剂型、给药频率、辅料、容器密封系统、器械和技术以及产品信息页中的使用者说明等。
根据欧洲统计局,到 205...
|

|
欧盟发布基于患者登记的研究指南草案
2020.09.26
欧洲药品管理局(EMA)于 9 月 24 日发布有关基于患者登记的研究指南草案,为在药品许可前和许可后阶段使用患者登记提供了详细的建议。
基于患者登记的研究(Registry-based study)是一个或多个新的或现有登记库的基础结构对研究问题进行调查,以招募患者和收集数据。基于登记的...
|

|
欧盟开始审评用于新冠治疗的地塞米松药品申请
2020.09.03
欧盟药品管理局(EMA)于 9 月 2 日表示,正在评估 Taw Pharma 的类固醇药物地塞米松 Taw(Dexamethasone Taw),作为 COVID-19 成年住院患者的潜在治疗方式。EMA 人用药委员会(CHMP)已经从 8 月 31 日开始审评 Taw Pharma 的上市申请。
该药的申请由英国咨询公司 Taw...
|

|
欧盟发布亚硝胺杂质问答指南,给出杂质评估、检测和缓...
2020.08.10
欧洲药品管理局(EMA)于 8 月 6 日发布更新后的问答指南文件为上市许可持有人(MAH)提供了有关亚硝胺杂质处理的建议。指南给含化学合成 API 的 MAH 更多时间用来评估产品中是否存在有潜在致癌性的亚硝胺杂质,还为含生物药 API 的制剂的 MAH 执行类似的评估设定了新的截止日期...
|

|
欧盟人用药中亚硝胺杂质评估报告要点
2020.07.20
欧盟药品管理局(EMA)于 7 月 9 日发布《人用药中的亚硝胺杂质评估报告》,详细解释了有关亚硝胺杂质根本原因调查、科学讨论以及专家组意见,并为制药公司提供了有关如何避免人用药中亚硝胺杂质存在的建议。
除了 EMA 已经要求对含化学合成 API 的药品申办人对其产品中可能存...
|
|
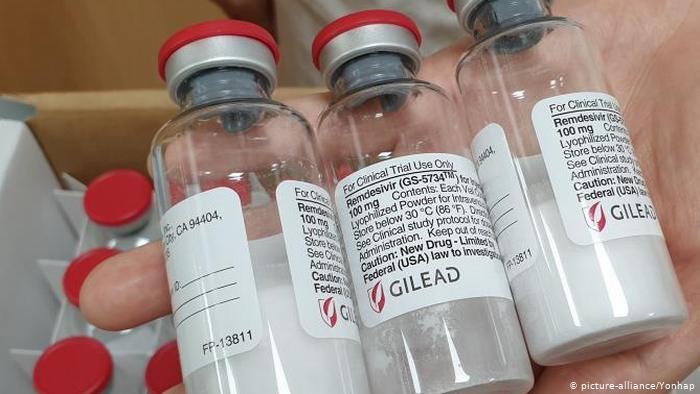
瑞德西韦欧盟获批在即,定价模型修订基准价格有所提高
2020.06.27
吉利德(Gilead Sciences, Inc.)公司的瑞德西韦已在欧盟获得有条件上市许可建议,预计将在下周正式获得批准。根据许可建议,瑞德西韦用于 12 岁以上新冠(COVID-19)重症患者,并且仅限于在可以对患者进行密切监视的医疗机构中使用。上市后,吉利德需在规定时间限内提交最终报...
|

|
欧盟发布大流行期间的远程 GCP 检查指南
2020.06.12
欧洲药品管理局(EMA)于 6 月 10 日发布《COVID-19 大流行期间远程 GCP 检查指南》,解释了在 COVID-19 大流行期间如何根据人用药评估委员会(CHMP)的要求具体情况具体分析地远程开展 GCP 检查。
EMA 认为 GCP 检查是“必不可少的”,在目前情况下,应重点关注申办人...
|

|
EMA 提供针对欧盟和非欧盟市场产品的同步审评
2020.05.29
优化监管审评资源, 防止两次申报间的审评差异
欧洲药品管理局(EMA)正在对那些既申请针对整个欧盟市场又申请针对非欧盟国家市场的药品或疫苗提供同步审评的可能性。
EMA 解释指出,欧盟集中上市许可申请(MAA)和根据第 58 条(欧盟外使用药品)申报的同步审评将有助于优化国...
|

|
EMA 表示将很快就瑞德西韦有条件上市许可做出决定
2020.05.19
欧洲药品管理局(EMA)执行主任 Guido Rasi 表示,EMA 可能很快做出决定是否许可吉利德(Gilead)公司的瑞德西韦(remdesivir)用于治疗新冠疾病(COVID-19)患者。
Rasi 于 5 月 18 日对欧洲议会的环境、公共卫生和食品安全委员会(ENVI)表示,“根据所提交的数据以及专家...
|

|
新冠疫苗安全性监测和伴随用药研究成为全球监管关注重...
2020.04.23
欧洲药品管理局(EMA)预计,到今年年底,将建成一个新系统来密切监视在欧盟使用的新冠(COVID-19)疫苗的安全性和有效性。英国也宣布计划通过使用初级医疗卫生数据库 CPRD(临床实践研究数据链)执行国家疫苗警戒实时监控。
EMA 在 4 月 6 日药品监管机构国际联盟(ICMRA)主持...
|

|
欧盟关注临床试验使用的计算机化系统验证
2020.04.17
欧洲药品管理局(EMA)最近发布通告,表达了对最近检查揭示的临床研究中使用的计算机化系统缺乏验证和确认的关注。
EMA 在通告中表示,未能记录和证明计算机系统的已验证状态可能会对数据完整性、可靠性和稳健性造成威胁。取决于受影响数据的严重程度,可能会导致 GCP 检查员建议不...
|

|
来自欧盟的专业贺礼 – MAH和GMP法规体系官方梳理
2020.01.23
前天,EMA公布了GMP和MAH思考性文件的征求意见稿(Reflection paper on good manufacturing practice and marketing authorisation holders)。该指南系统的梳理了欧盟MAH的法规体系,及其和相应GMP文件的对应关系,识林正在翻译这份指南,并建设该专栏。
MAH相关法规指南数量...
|

|
欧盟药品短缺网络试点进入第二阶段
2020.01.17
欧洲药品管理局(EMA)和药品机构(HMA)于2016年12月成立了HMA/EMA人用和兽用授权药品供应https//www.hma.eu/522.html 特别工作组,以提供战略支持和建议,来解决人用药和兽药供应中断的问题,并确保其持续供应。其主要优先事项包括
研究如何利用现有的监管框架(例如,通过工...
|
|
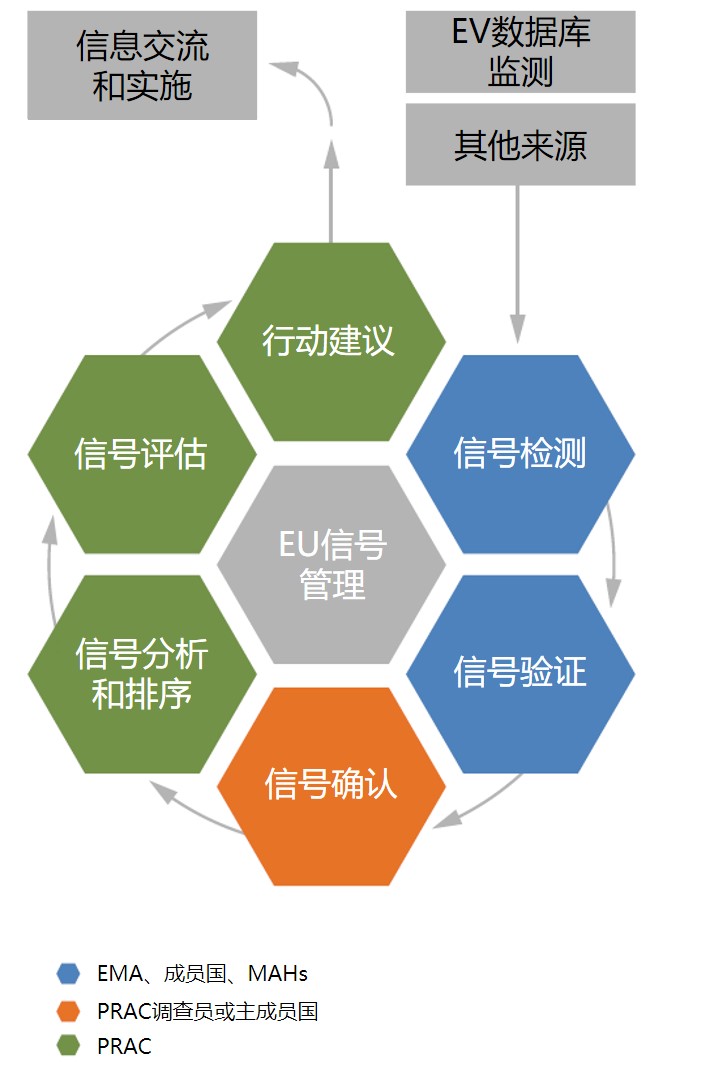
欧盟延长安全信号检测试点至 2021 年底
2020.01.08
安全信号是指新的或已知的可能由药物造成,并需进一步研究的不良事件的信息,它的来源包括:自发报告、临床研究、科学文献等。欧盟法规要求上市许可持有人(MAH)持续监测药物警戒系统数据,并向欧洲药品管理局(EMA)和成员国药监局报告检测到的经验证的安全信号。
欧盟的安全信号检测...
|

|
欧洲药品管理局着手机构改革,应对新挑战
2019.12.24
欧洲药品管理局(EMA)将着手开展涉及机构改革的“面向未来”的行动,以使其能够更有效地应对“人员的永久减少”以及在科学、技术和立法方面的新挑战。
EMA 管理委员会 12 月会议上提出的新架构包括成立四个新的工作组,以聚集在“高影响力领域”的专家,例如数字化转型、监管科学与...
|

|
无菌药品检查国际合作试点启动,中国和印度或将面临更...
2019.12.19
欧洲药品管理局(EMA)于 12 月 17 日宣布启动一项为期两年的无菌药品 GMP 检查国际合作试点计划,该计划可以使包括欧盟、美国、英国、澳大利亚、加拿大、日本等国在内的监管机构共享无菌药品生产场地的 GMP 检查信息。参与机构由此而节约的检查资源或将更多的集中在高风险场地和...
|

|
EMA 领导人对 2030 年药物警戒的三大趋势预测
2019.12.17
到 2030 年,药物警戒的关键因素将包括更智能地收集和报告可疑不良反应的安全报告,衡量在市场上的药品表现以及改善监管机构、患者和医疗保健专业人员之间的互动。以上这些预测来自欧洲药品管理局(EMA)执行主席 Guido Rasi、EMA 安全委员会(PRAC)主席 Sabine Straus 以及 EMA...
|

|
EMA 将采取措施避免药品审评过程中的偏见
2019.11.28
几个月前我们曾报道过欧洲监察使建议欧洲药品管理局(EMA)采取几项措施,以确保与制药商就上市申请进行的申报前会谈不会影响审批决定。【申报前会议可能给 EMA 审批过程带来偏见? 2019/08/16】现在故事有了新进展,EMA 宣布同意采纳欧洲监察使的建议。
EMA 在 11 月 21 日回应...
|