
|
FDA 检查现状:检查员流失,海外突击检查继续实施,...
2024.11.14
美国政府问责办公室(GAO)于 11 月 13 日发布了一份题为“药品安全:FDA 应实施策略以留住其检查人员 ”的国会委员会报告,详细说明了对 FDA 药品检查计划人员配备的担忧,以及 FDA 现在开展的检查仍比疫情前高峰期检查次数少得多的事实。
从这份报告中我们还可以更为全面的了...
|

|
美国政府报告要求 FDA 加强临床研究检查,FDA 计划...
2024.04.02
美国政府问责办公室(GAO)最近发布了一份题为“FDA 应评估其招募和留住检查人员的努力”的关于 FDA 检查的最新报告 检查以确保监督支持药品批准研究的机构符合必要的标准。这些检查涉及生物研究监测(BIMO)对医院、临床研究组织(CRO)和其它进行临床试验工作的类似设施的检查。
G...
|

|
美国政府审查报告提出 11 项政策建议促进再生医学发...
2023.07.27
美国政府问责办公室(GAO)最近公布了一份新的技术评估报告,审查再生医学的治疗应用、挑战和政策选项。GAO 表示再生医学公司面临着许多挑战,这些挑战限制了突破性新疗法的开发和使用。
GAO 对当前和新兴的再生医学技术和治疗应用进行了评估。报告探讨了(1)当前和新兴的再生医学技...
|

|
美国政府报告要求增加对临床研究机构审查委员会的监管
2023.03.23
今年 1 月份,美国政府问责办公室 (GAO) 发布了一份报告《机构审查委员会 — 提高联邦监督和检查效力所需的行动》,向FDA和卫生部(HHS)提出多项建议,以加强其对机构审查委员会(IRB)审查临床试验的监督。
GAO为立法部门政府机构,是美国联邦政府最高的审计与监督机构。机构审...
|

|
美国政府审查报告建议 FDA 采取更多措施鼓励药品制...
2023.03.15
美国政府问责办公室(GAO)于 3 月 10 日发布了一份题为“药品制造:FDA 应全面评价其鼓励创新的努力”的审查报告,呼吁 FDA 更好地鼓励先进药品制造实践的采纳。GAO 对来自行业的 15 名利益相关者的采访揭示了,先进技术采纳的延迟与监管不确定性相关。
除了不鼓励更先进的...
|

|
美国政府调查报告:改变危险病原体的研究应得到更好地...
2023.01.20
美国政府问责办公室(GAO)于 1 月 18 日发布了一份报告称,卫生部门对可能增强危险病原体研究的监督模糊,缺乏透明度,并且“不完全符合有效监督的关键要素。”
美国国立卫生研究院(NIH)有一个生物安全顾问委员会,预计将在 1 月 27 日的会议上讨论机构对此类研究的监督...
|

|
美国政府报告建议 FDA 加快招聘海外检查员和翻译服...
2022.02.09
上周,识林资讯报道了美国对海外药企的现场监督检查采取对本土药厂一样政策的立法提案,并讨论了 FDA 国外突击检查试点执行方面的一些预测。本周,美国政府问责办公室(GAO)继续为 FDA 国外突击检查添柴加火,为 FDA 改善国外检查计划提供具体实施建议。
GAO 在 2022 年 2 ...
|
|
美国政府审查报告证实新冠疫苗生产场地在获得授权之前...
2021.11.03
一直关注识林的读者可能还记得,去年 12 月份我们就曾讨论过 FDA 授权新冠疫苗之前并没有做批准前检查。现在美国政府的官方报告数据出来了,没做批准前检查是确定的,而其中的一些原液和重要辅料工厂甚至从未接受过 FDA 的检查。
美国政府问责办公室(GAO)在一份最新的报告中表...
|

|
FDA 检查问题再次被摆上听证会桌面,新老问题齐发
2021.03.08
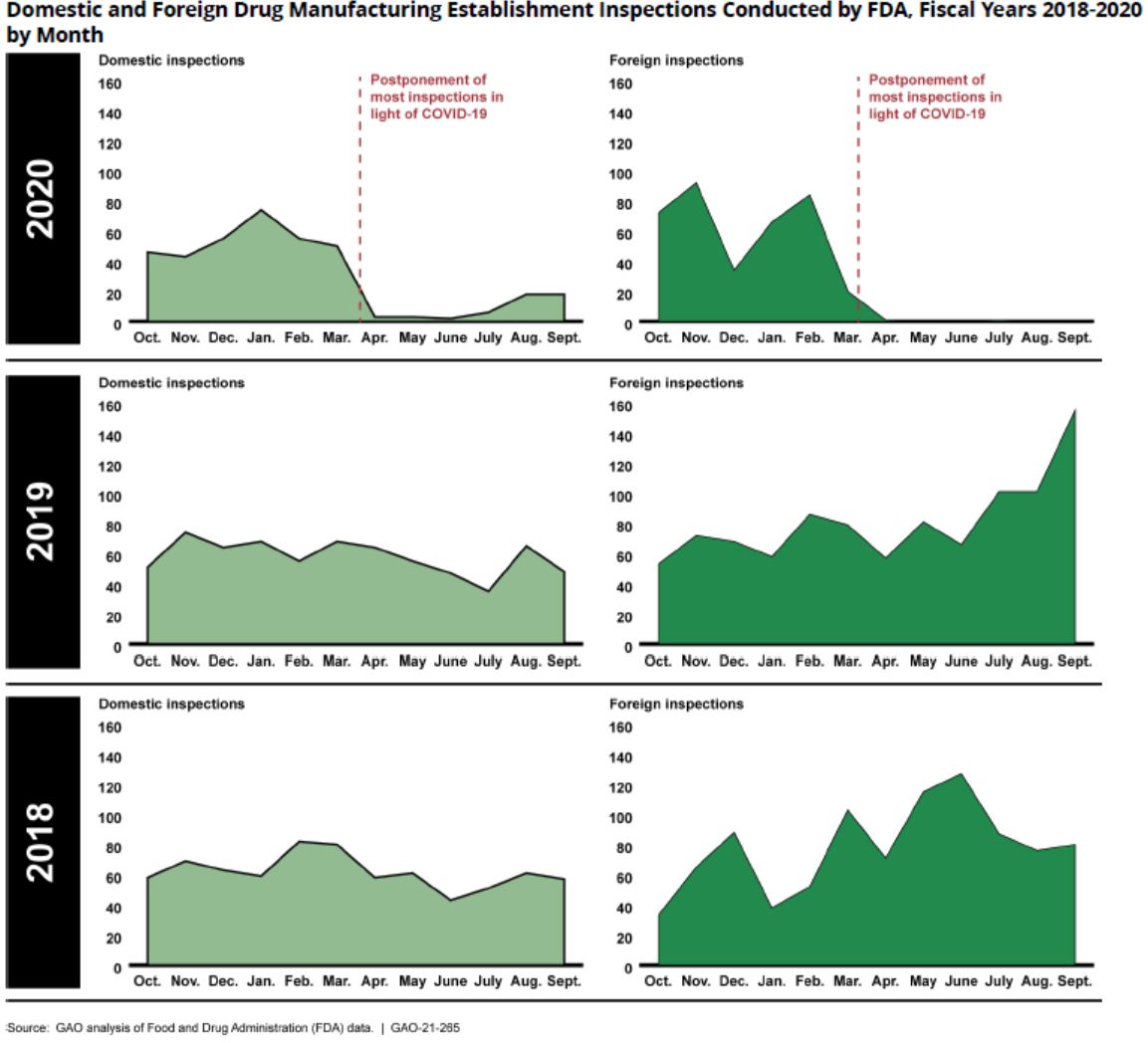
美国政府问责办公室(GAO)官员表示,FDA 需要确保由于新冠(COVID-19)旅行限制导致的逾期监督检查积压数量不会损害其未来执行“高风险”检查的能力。
GAO 医疗卫生小组主管 Mary Denigan-Macauley 在 3 月 4 日提交的关于 FDA 检查的听证会的书面证词中表示,FDA 还应...
|
|
美国政府报告呼吁 FDA 考虑检查替代方法解决积压,...
2021.02.05
美国政府问责办公室(GAO)于 1 月 28 日发布了一份题为《COVID-19:关键疫苗分配,供应链,项目完整性,以及其它需要联邦政府重点关注的挑战》的近 350 页的报告(报告全文和治疗产品、医护用品供应链、卫生保健指标数据收集、药品生产检查、联邦合同、工人安全和健康监督、对渔业...
|

|
老问题新热度:FDA 再次因海外检查不力饱受批评
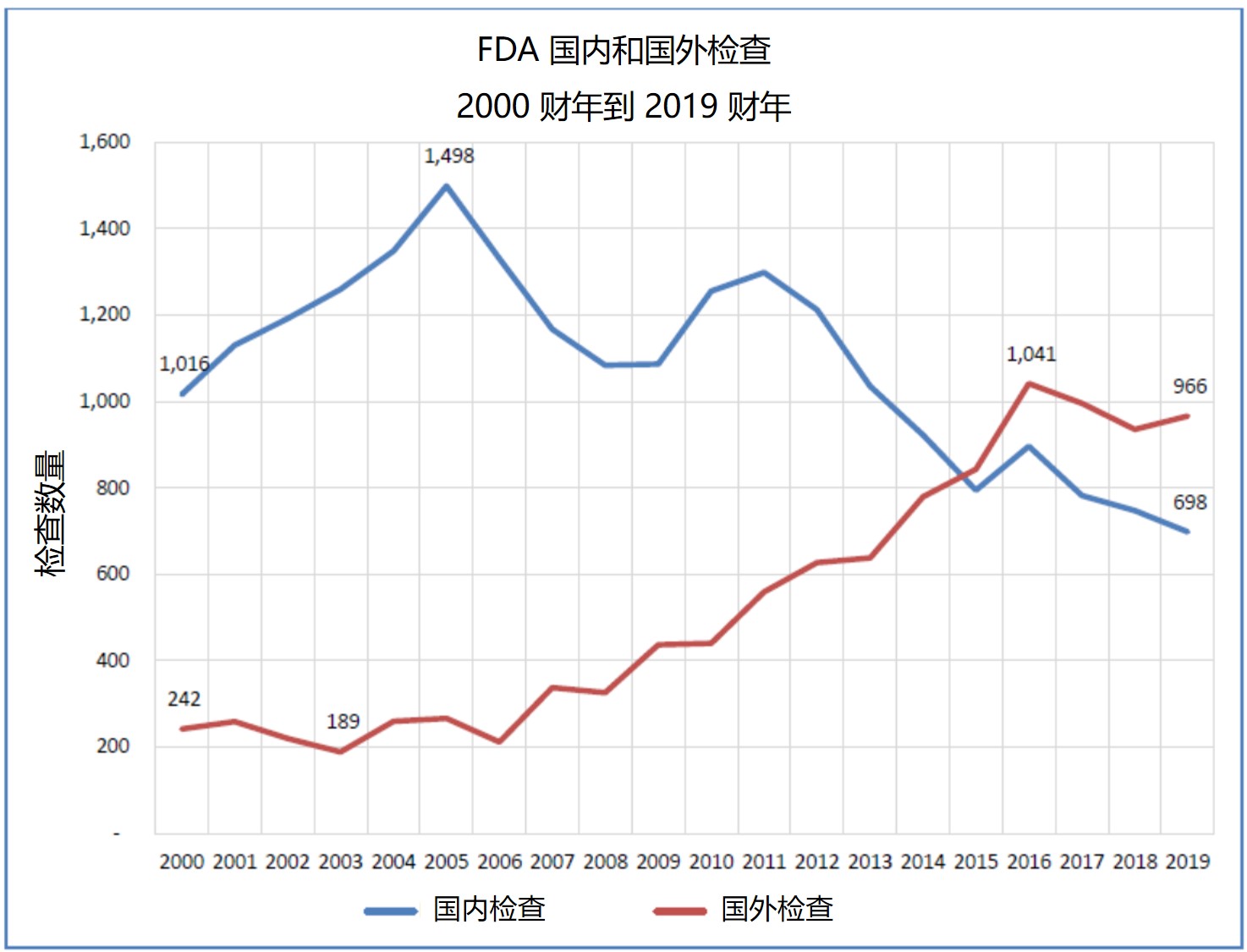
2020.06.04
国外检查提前通知,依赖企业方提供翻译,大流行期间停止国外检查的影响等。
美国 FDA 再次因其在国外药品生产设施检查方面的问题受到国会和美国政府问责办公室(GAO)的诘难。问题都不是新问题,有些问题甚至已经被提了有十年之久,但是在新型冠状疾病(COVID-19)大流行以及国际大...
|
|
FDA 药品中心主任表示国外检查需要更多检查员和翻译...
2019.12.12
美国 FDA 药品审评与研究中心(CDER)主任在 12 月 10 日举行的众议院能源与商业监督小组委员会关于“保护美国药品供应链:监督 FDA 国外检查计划”听证会上表示,如果国会批准,FDA 可以使用更多资源执行更多国外检查。听证会上,Woodcock还为有关 FDA 严重依赖国外提前通知的...
|

|
FDA 因对中国和印度工厂检查不力受到质疑
2019.07.04
由于美国民众持续关注从其它国家进口的药品,以及近期对使用海外原料药生产的降压药的一系列召回的持续担忧,美国众议院和参议院议员要求 FDA 解释其是如何保护药品供应链的。与此同时,众议院的一个两党小组希望美国政府问责办公室(GAO)审查 FDA 的检查计划。
在上周晚些时候发...
|

|
制药行业热捧罕见病用药,FDA 被指有悖《罕见病用药...
2018.12.05
美国政府问责办公室(GAO)于近日公布题为《罕见病用药:FDA应提高罕见病用药认定审评一致性;罕见病用药研发挑战犹存》的报告。报告显示,随着制药商竞相热捧罕见病用药认定,FDA并没有能够持续记录和评估所需信息。报告称,FDA未能确保罕见病用药认定符合《1983年罕见病用药法案》的初衷...
|

|
GDUFA I 实施核查:审评时间下降但FDA需对结余费用...
2017.06.29
美国审计总署(GAO)本周发布了一篇题为《仿制药使用者付费:申请审评时间下降,但 FDA 应制定计划管理未支配的使用者付费》计划;(2) 阐述了 FDA 对仿制药申请审评过程的改进;(3) 分析了仿制药申请审评时间的变化。在报告附录中,GAO 还包括了对 GDUFA 资助的并在 GDUFA ...
|

|
FDA在药品短缺方面的工作受到质疑
2017.02.20
美国审计总署(GAO)于2月15日发布有关联邦政府“高风险领域”情况的国会报告。GAO的高风险计划将注意力集中在对欺诈、浪费、滥用和管理不善或需要转型以解决经济、效率或有效性挑战的具有较大弱点的政府运营。其中FDA面临的高风险领域为药品短缺,GAO在报告中认为FDA处理药品短缺问题的努...
|

|
FDA国外药品检查有所改善但仍需提高
2017.01.25
美国审计总署(GAO)在1月17日发布的一份报告
中敦促FDA开展更多工作加强其国外药品检查计划,GAO注意到FDA对于三分之一的向美国出口药品的国外制造设施仍未予以检查。GAO鼓励FDA更好地评估其海外办公室的成效,并为这些海外办公室设定人员配置目标。美国卫生与人类服务部(HHS)代表FDA...
|

|
复杂仿制药 – 摆在FDA面前的巨大问题
2016.03.07
我们在之前一篇资讯中提到FDA前副局长Scott Gottlieb医师在GPhA年会上组织了一个三人专家会,会上讨论了对复杂药品的长审评时间问题,在这篇资讯中来看一下具体的讨论。
在小组讨论会上,Scott Gottlieb首先提出这一话题,是否应为复杂仿制药制定另外一种批准过程,从而让FDA阅览一些...
|

|
FDA加速审批药品的上市后安全监管数据有待加强
2016.02.16
上个月,美国审计总署(GAO)公开发布关于FDA处理药品上市后安全监管的报告调查结果,GAP是向国会提供审计、评估和调查服务的独立的无党派机构。报告的标题为《FDA加速许多申请的审评,但批准后监管数据亟待加强》)更快进入市场的药品的安全性。GAO报告受国会议员康涅狄格州民主党人Rosa ...
|

|
美国国会议员要求审查FDA对亚洲药品工厂的监管
2015.12.23
出于对制药供应链质量的担忧,一些国会议员希望美国审计总署(GAO)审查和评估美国食品和药品管理局(FDA)监管国外生产工厂的进展。
上周五的一封信函中,众议院能源和商务委员会的委员要求GAO评估FDA自2010年着手开展新的“基于风险”的路径对国外设施检查的进展。他们指出,美国每年...
|