|
印度禁止使用与乌兹别克斯坦止咳糖浆死亡事件相关的丙...
2023.03.13
印度要求制药商停止使用来自印度德里一家公司 Maya Chemtech 的丙二醇,该公司曾向 Marion Biotech 供应该成分,Marion 的止咳糖浆与乌兹别克斯坦 19 名儿童的死亡相关。
乌兹别克斯坦去年 12 月表示,19 名儿童在使用 Marion 的止咳糖浆 Ambronol 和 DOK-1 Max 后...
|

|
FDA再对印度制药商发483,在垃圾袋中发现受控记录碎纸
2023.03.08
美国 FDA 日前公布了其发布给印度最大的仿制药制造商之一 Cipla 的长达 23 页的 483 报告。报告中,FDA 列举了许多检测和记录保存程序的失败以及大量客户投诉。
FDA 在上个月对位于印度中央邦的 Cipla 工厂进行了为期 10 天的检查,在 483 中列出了 8 个重大观察项,...
|

|
FDA 发布 36 页长 483 报告详述印度工厂数据可靠...
2023.01.26
美国 FDA 最近在一份签发给印度 Intas 药业的 483中严肃谴责该药厂因一系列质量控制缺陷而导致“一连串失败”。
根据 FDA 于 1 月 18 日公布了去年 11 月底在检查了位于印度古吉拉特邦 Intas 工厂之后发出的长达 36 页的 483 报告,Intas 药业多次违反 GMP,存在的问...
|

|
印度产止咳药接连陷入二甘醇污染丑闻,Ranbaxy 揭发...
2023.01.18
受乙二醇和二甘醇污染的由印度 Marion Biotech 生产的止咳糖浆去年 12 月在乌兹别克斯坦再次造成至少 19 名儿童死亡。去年夏天,冈比亚就至少有 70 名儿童在服用印度 Maiden 药业生产受污染咳嗽药后死于肾衰竭。
就在冈比亚事件公开的几天之前,一本由 Dinesh S. Thakur 和 Pras...
|
|
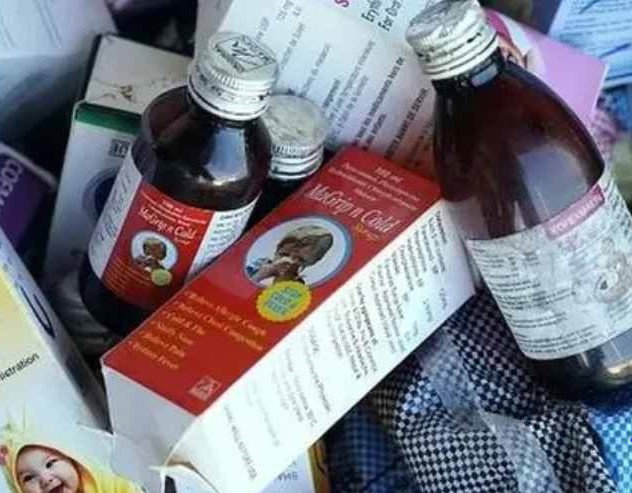
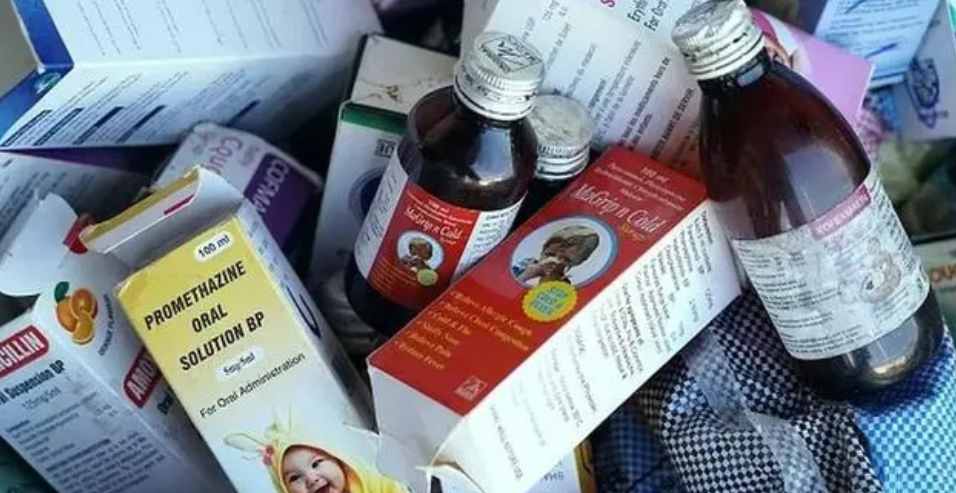
WHO 再就印度产止咳糖浆二甘醇污染致死发布警报
2023.01.17
2023 年一开年,世界卫生组织(WHO)就又发布了一份医药产品警报,警示不要使用两款印度产止咳糖浆,并指出这两款止咳糖浆已导致乌兹别克斯坦至少 20 名儿童死亡。
WHO 在警报中指出,这两款止咳产品分别是 AMBRONOL 糖浆和 DOK-1 Max 糖浆,由印度 Marion Biotech 生产,...
|
|
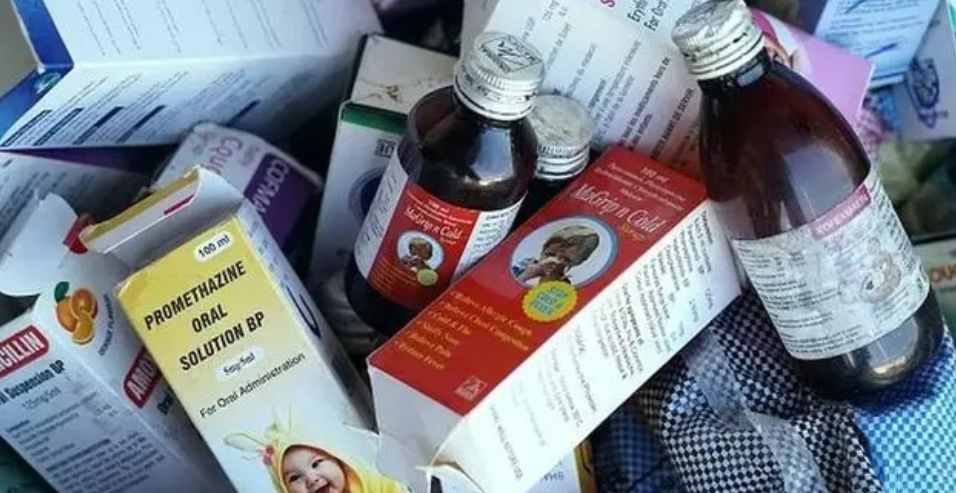
二甘醇污染止咳糖浆后续:WHO、印度政府各执一词,涉...
2022.12.19
印度 Maiden 药业于 12 月 16 日表示,在印度政府实验室发现从 WHO 怀疑与冈比亚儿童死亡有关的糖浆中提取的样本没有任何问题后,Maiden 将寻求重新开放其工厂的许可。
Maiden 董事总经理 Naresh Kumar Goyal 表示,“我对印度的监管和司法程序充满信心。我没有做错任何...
|

|
印度中央和地方药监机构对涉嫌二甘醇污染止咳糖浆生产...
2022.10.13
WHO 于 10 月 5 日对印度 Maiden 药业的四种止咳产品发布警报,怀疑产品被二甘醇和乙二醇污染从而与西非冈比亚数十名儿童死亡有关。之后印度地方和中央药监机构对涉事药厂进行了检查,并于 10 月 7 日发布因由通知,列出多项违规行为,包括未对所用丙二醇中的二甘醇和乙二醇进...
|

|
WHO警示印度生产的止咳糖浆因二甘醇和乙二醇污染致使...
2022.10.07
世界卫生组织于 10 月 5 日发布医药产品警报,要求监管机构将印度 Maiden 药业的四种止咳产品从市场上撤销。WHO 怀疑西非冈比亚 66 名由于急性肾损伤而死亡的幼儿可能与该家制药商生产的受污染的咳嗽和感冒糖浆有关。
WHO 在警报中表示,这些产品可能已通过非正规市场在其它...
|

|
FDA 疫情期间对印度公司的检查情况如何?
2021.08.26
美国 FDA 现场检查时间表的不确定性是印度药企第一季度财报会上反复讨论的话题。从 2021 年 2 月到 2021 年 8 月,FDA 在印度进行了七次药品检查。我们通过一些印度企业的财报电话会看看当前检查的开展情况以及印度药企对检查的期待。
FDA 表示,鉴于疫情的不确定性,FDA ...
|

|
科学家批评印度在缺乏有效性数据的情况下匆忙批准新冠...
2021.01.08
《科学》(Science)杂志网站近日发文指出,印度药品监管机构在没有等待确定的有效性和安全性 III 期试验结果的情况下,于 1 月 3 日授权了印度 Bharat Biotech 公司开发的新冠(COVID-19)疫苗 Covaxin,这一行动引发了一些科学家和患者倡导组织的严厉批评。
在周日的新闻...
|

|
英国和印度或于下周批准阿斯利康新冠疫苗
2020.12.24
印度很可能在下周批准牛津/阿斯利康的新冠(COVID-19)疫苗用于紧急使用,可能成为第一个为阿斯利康疫苗提供监管许可的国家。而英国紧急情况科学顾问小组成员本周三也表示英国政府可能会在圣诞节之后授权阿斯利康疫苗。
据路透社报道,印度作为世界上最大的疫苗生产国,希望在下个月...
|

|
印度新冠疫苗试验不良反应引发质疑,辉瑞疫苗需要在印...
2020.12.22
印度药品管理总局(DCGI)可能会要求辉瑞/BioNTech 寻求在印度的加速批准(类似于紧急使用授权)之前进行本地临床试验。
这可能是辉瑞/BioNTech 在全球批准道路上遇到的第一个关卡。在 12 月 9 日 DCGI 的专家委员会上,辉瑞印度公司曾希望有更多时间做介绍。在那之后,辉瑞...
|

|
印度制药业反思对中国的依赖,希冀重获全球 API 主...
2020.09.07
一场疫情改变了整个世界的形势,也让潜藏的矛盾迅速浮出水面。全球对供应链,尤其是事关生命健康的医药产品供应链的关注日益增加,印度也不例外。在大势所趋之下,知己知彼、未雨绸缪才能做到因势利导、适时调整、合理应对。
近日,福布斯印度网站上刊发了一篇特别报告,详细介绍了印...
|

|
印度药企呼吁 FDA 在疫情期间执行虚拟现场检查
2020.05.06
作为全球最大的药品出口国之一的印度正受到新型冠状病毒疫情的沉重打击,原因是全球旅行限制使得药厂日常运行复杂化,其中一个原因就是,FDA 对国外检查已暂停将近两个月,并且没有丝毫的恢复迹象。印度药企正在努力寻找解决方案,希望 FDA 在疫情期间对生产场地执行虚拟检查。
根据...
|

|
印度加大力度降低对中国原料药的依赖,禁止羟氯喹出口
2020.03.28
最近印度有两条消息值得制药业加以关注。
首先,印度商务部对外贸易总局于 3 月 25 日发布通知,禁止将任何羟氯喹药物和制剂运出国外,必须履行现有合同的公司以及出于人道主义理由必须由外交事务部逐案批准的公司除外。
其次,印度政府为确保长期药物安全已拨款 13.2 亿美元促...
|

|
美国印度开展双边执法行动查处非法药品快递
2020.02.20
2月18日美国 FDA 宣布了与印度政府于 1 月份开展的首次双边执法行动,这次行动阻止了约 500 批次非法的、潜在危险的、未经批准的处方药和组合器械运抵美国。
FDA 局长 Stephen Hahn 表示,“由于每个国家/地区的标准和法规不尽相同,美国消费者在从未经授权的国外来源订购药品...
|

|
美国 FDA 向印度制药与器械企业发布的警告信分析
2019.11.21
在过去 14 年内,FDA 向印度制药和器械企业发出的警告信数量逐渐增多。在警告信列出的所有违规行为中,85.87% 与 CGMP 不合规有关。此外,在这些警告信中有 80.72% 在之后没有关闭函。
这一回顾性研究于 11 月 5 日发布于 DIA 《治疗创新与监管科学杂志》上,分析回顾了 20...
|

|
印度药业反击质量问题指责,兰伯西揭发者尖锐回应
2019.08.02
关于印度制药业数据可靠性和质量管理的问题,我们经常看到的是监管机构的视角,现在我们换个角度,从当事人的视角来看看,本文摘选整理了印度 Biocon 药业掌门人 Kiran Mazumdar Shaw 发表在印度媒体上的公开言论,以及原兰伯西(Ranbaxy)高级管理层、Ranbaxy 案件的揭发者 Dinesh ...
|

|
数据可靠性危机导致 Apotex 撤销 31 件已获批 AND...
2019.07.11
加拿大制药商 Apotex 公司因其在印度班加罗尔的两家工厂持续存在数据可靠性和质量部门失效问题,而要求撤销美国的 31 个获批仿制药申请。美国 FDA 于 7 月 10 日在联邦公报上发布撤销通告,并列出具体撤销名单。
Apotex 公司撤销仿制药申请的决定是近年来数据可靠性危机所...
|

|
印度太阳药业鼓励员工检举的新政策:说一套做一套?
2019.05.13
世界最大的仿制药供应商之一 — 印度太阳药业(Sun Pharma)于 4 月 17 日发布了一封内部电子邮件,鼓励员工检举包括内部交易在内的不当行为。但结合之前发生在该公司的内幕交易指控和解案,公司似乎在采用说一套做一套的双重标准。
首先,整个故事要从一件内幕交易指控说起。该...
|