
|
欧盟基因和细胞治疗药物开发指南,含 CAR-T 细胞的...
2020.12.21
欧洲药品管理局(EMA)更新了其针对具有转基因细胞的新药开发的行业指南,其中包括有关嵌合抗原受体 T(CAR-T)细胞治疗药物的特殊临床考虑的附录。新指南指出,“EMA 已经认识到,这是一个不断发展的领域,指南应可以在合适的情况下应用于任何新产品。”
这份 36 页的指南提供了...
|

|
【周末杂谈】法律、律师与 FDA
2020.12.20
识林建议讨论一位读者的问题:为何美国的律所律师对FDA的监管那么熟悉?
本人既非律师,也无律所或FDA任职经验,只作为旁观者和外行,杂谈一下。
FDA存在的唯一理由是落实美国药品法。药品法是联邦法,是对跨州商贸的约束,FDA的一切举动都必须以此法为依据,所制定的规章、指南和政...
|

|
新冠疫苗领跑者已撞线,后来者面临更多试验执行困难
2020.12.19
随着几款新冠(COVID-19)疫苗陆续在多个国家获得紧急使用授权或暂时使用,目前仍然在试验中的疫苗可能面临这更多问题,包括揭盲策略、参与者脱落、两种不同疫苗之间的相互作用等等。
在 FDA 上周批准首个 COVID-19 疫苗之时,阿斯利康向在美执行临床试验的研究者发出了文件,说...
|
|
FDA 关于 Moderna 新冠疫苗紧急使用授权的专家会资...
2020.12.18
美国 FDA 于 12 月 17 日召开疫苗与相关生物制品专家委员会(Advisory Committee)会议讨论 Moderna 的新冠(COVID-19)疫苗 mRNA-1273 的有效性和安全性是否足以支持紧急使用授权(EUA)。会议表决结果为:20 赞成,0 反对,1 弃权。有关会议讨论的详细报道请见【快讯】Mode...
|
|
【快讯】Moderna 新冠疫苗专家会意见,20-0 支持紧...
2020.12.18
北京时间 12 月 18 日早 6 点 10 分,美国 FDA 就 Moderna 新冠(COVID-19)疫苗 mRNA-1273 的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天 8 个多小时对 Moderna 新冠疫苗的广泛讨论后,外部专家以 20 赞成,0 反对,1 弃权,认为基于可用全部科学证据,Moder...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|

|
FDA 发布仿制药研发受控函定稿指南
2020.12.17
美国 FDA 于 12 月 16 日发布《与仿制药研发相关的受控函》定稿指南。受控函(controlled correspondence,CC)是向 FDA 询问有关 Q1Q2、批次大小或括号法策略、非活性成分水平,甚至是一般性的批准后提交要求的工具,方便易用,可以让企业了解 FDA 对于企业具体研发产品的期...
|

|
免费线上讲座(中文翻译):FDA 生物制品研发、合规...
2020.12.16
【识林-Hogan Lovells】FDA 生物制品法规:法律框架与合规优先事项, 2020.12 link=13px
美国 FDA 生物制品法规框架如何?监管要求、批准途径和专营权方面与我们日常所熟悉的小分子药品有何区别?生物制品的制造与合规挑战如何?生物制品场地常见检查观察项的前车之鉴有哪些...
|
|
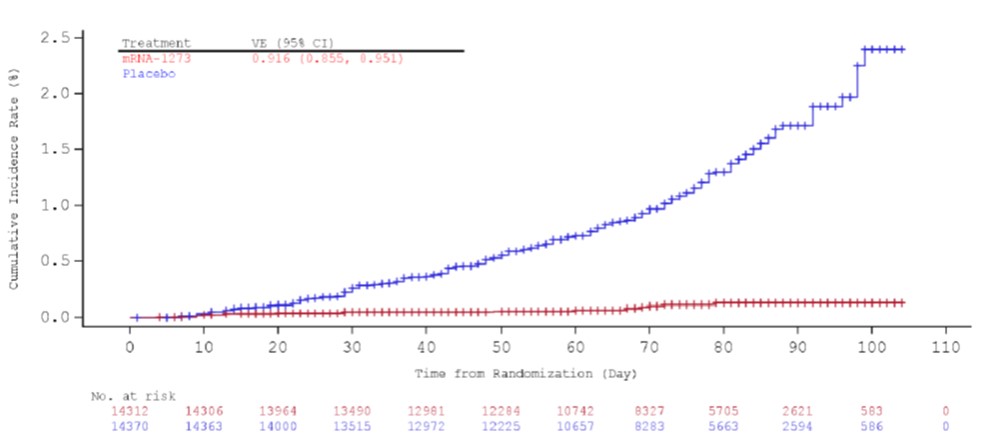
Moderna 新冠疫苗专家会会前资料,非常有效但不良反...
2020.12.16
美国 FDA 于周二(12月15日)发布了针对 Moderna 新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为该疫苗安全有效。
在计划于本周四召开的疫苗和相关生物制品咨询委员会会议上,外部专家将投票表决 Moderna COVI...
|

|
欧洲药品监管 2025 战略关注药品可及性和供应链挑战
2020.12.15
欧洲药品管理局(EMA)和欧盟药品机构(HMA)于 12 月 8 日发布了《2025 药品监管网络战略》,对于未来五年的欧盟药品监管网络,药物可及性和可获得性被列为首要议题,其次是创新、供应链挑战、抗菌素耐药性等问题。
与战略同时发布的还有对战略草案征求意见结果的分析和总结,战...
|

|
新全球联盟推动分散式临床试验的实施
2020.12.15
12 月 10 日,一个新的国际联盟 — https//dtra.org/dtra-launches-to-democratize-and-accelerate-clinical-trials/ 分散式试验与研究联盟(DTRA)启动,目的是解决整个研究界利益相关者在有意义地采用分散式试验方面持续面临的“重大障碍”。目前成员有 50 个组织,包...
|

|
【一周回顾】2020.12.07-12.13
2020.12.14
国家局就药品年度报告管理规定和报告模板公开征求意见。药审中心发布药物研发与技术审评沟通交流管理办法,公开ICH 指导原则培训视频与课件资料。FDA 召开疫苗专家会,颁布首个新冠疫苗紧急使用授权。欧盟发布药品监管网络 2025 战略。ICH 就启动以患者为中心的药物开发指南制定征...
|

|
FDA 现场检查替代计划进展缓慢导致关键新药审批停滞
2020.12.14
新冠疫情爆发已经近一年,由于旅行限制和边界关闭等因素,药品监管所必须的现场检查工作难以开展,许多疫情高发的国家和地区先后提出替代现场检查的办法,但是美国 FDA 到现在为止还没有实质性的改变,而这已经影响到一些患者急需的挽救生命药物的短缺问题。
前 FDA 合规和生物制品...
|

|
【周末杂谈】生似药的规格与浓度
2020.12.13
FDA的强大不仅有赖于资源和科学,还因为对监管者的“监管”
美国东北时间本周五上午,白宫勒令FDA局长当天批准辉瑞的新冠疫苗,否则就被解职。所以,原本计划周六的批准,匆匆改为周五了。本文要谈的对监管者有规矩的监管,不是这样的管。
12月2日,美国Boehringer Ingelheim公司(...
|

|
ICH 将着手制定以患者为中心的药物开发指南
2020.12.12
ICH 正在就制定收集患者意见并将其纳入药物开发和监管过程的全球统一方法指南征求反馈意见,包括制定以对行业和监管机构都合理且可持续的方法收集患者观点的新的统一指南。
ICH 首先通过确定关键领域开启了这一拟议举措,ICH 认为收集患者意见可以改善药物开发的质量、相关性、安全...
|

|
EMA 新冠疫苗数据被黑客攻击,冷链组织或也受到网络...
2020.12.11
欧洲药品管理局(EMA)于 12 月 9 日在其网站上发布了一条简短的通知,透露 EMA 遭到网络攻击,但没有关于攻击程度的任何细节。但德国疫苗开发商 BioNTech 发表声明表示,其与辉瑞公司合作开发的新冠(COVID-19)疫苗 BNT162b2 有关的提交到监管机构的文件存储在 EMA 服务器...
|
|
【快讯】辉瑞新冠疫苗专家会意见,17-4 赞成紧急使...
2020.12.11
截至发稿前 20 分钟(北京时间 12 月 11 日早上 6:40),美国 FDA 关于辉瑞-BioNTech 的新冠(COVID-19)mRNA 疫苗 BNT162b2 召开的专家会刚刚结束。
经过 8 个多小时的数据演示、问答、讨论和辩论,外部专家们就“基于现有的全部科学证据,辉瑞-BioNTech COVID-19...
|

|
公益组织要求调查 FDA 阿尔茨海默药审评程序,暂停...
2020.12.10
消费者倡导组织公共公民(Public Citizen)要求美国卫生部(HHS)的总监察长办公室(Office of Inspector General)调查 FDA 与 Biogen(渤健)在准备其有争议的阿尔茨海默症药物的监管上市申请方面进行的“不适当合作”。
公共公民组织在批评 FDA 方面从来毫不手软,而 12 ...
|

|
抗癌药多国同步审批 Orbis 计划一周年概要数据
2020.12.10
最近《临床癌症研究》(Clinical Cancer Research)上发表了一篇监管科学和政策观点文章“Project Orbis Global Collaborative Review Program”1,介绍了 Orbis 计划过去一年的实施经验,作者是 Orbis 计划参与国监管机构的科学家们。
Orbis 计划(Project Orbis)于 201...
|
|
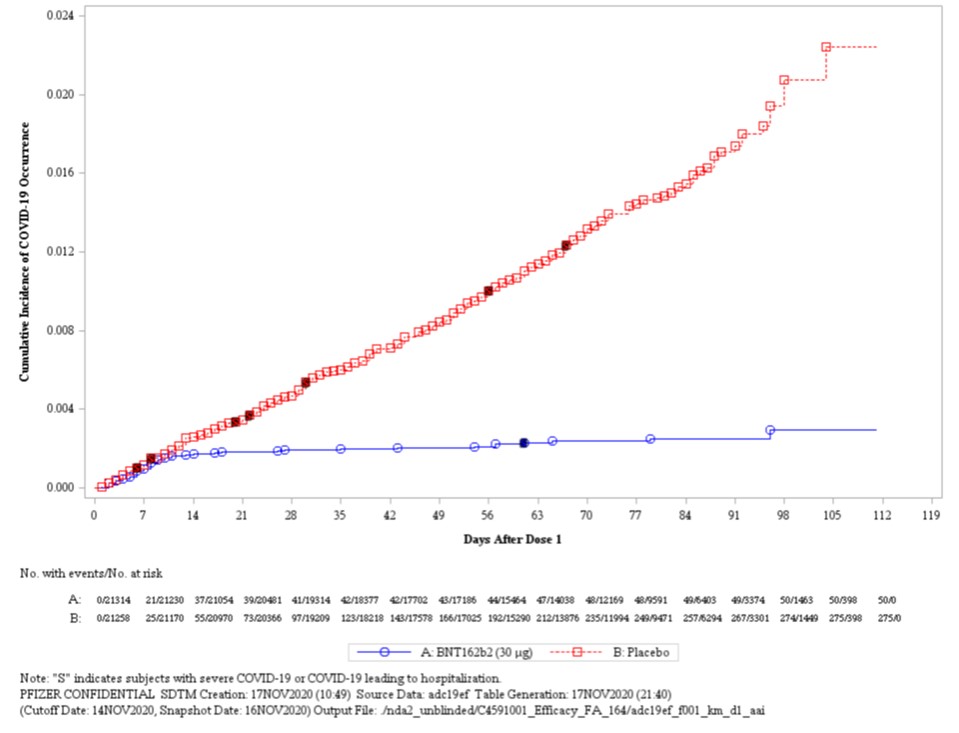
FDA 疫苗专家会会前资料公布,认为辉瑞新冠疫苗非常...
2020.12.09
美国 FDA 在周二(12 月 8 日)发布的疫苗专家咨询委员会(advisory Committee)会前资料中认可了辉瑞和 BioNTech 的新冠(COVID-19)疫苗 BNT162b2 的有效性和安全性。
这些文件是即将在本周四举行的疫苗外部专家会议的背景材料,此次专家会颇受关注,被视为是 FDA 颁发首个 C...
|