
|
线上讲座:从霉菌污染调查看微生物控制
2023.12.07
《制药工业微生物控制及无菌保障》读书分享会
微生物控制是无菌保障的关键点,也是无菌生产真正的特殊之处。PIC/S和欧盟无菌附录1提出污染控制策略(CCS),也指明需要从系统控制的维度,关注微生物。
王晓明医学博士于2023年4月出版的《制药工业微生物控制及无菌保障》一书,依据...
|

|
FDA就CAR-T Kymriah生产CGMP问题向诺华发布无标题信
2023.12.07
美国 FDA 于 12 月 5 日公布了一封 8 月份发给诺华的无标题信,信中概述了 FDA 检查人员在诺华新泽西 Morris Plains 工厂发现的 Kymriah(tisagenlecleucel)生产过程中与 CGMP 要求的重大偏离。
无标题信(Untitled Letter)可认为是 483 以上而警告信未满的情况下发...
|

|
稳定性研究相关缺陷、检查关注点和案例分享
2023.12.06
识林最近汇总了2013-2023财年FDA 483 年度审计缺陷列表,并发布了对2023财年483缺陷项的统计梳理。值得注意的是,在“实验室控制”一类中,有一条关于稳定性研究的缺陷项,是首次出现的全新表述。该缺陷项描述为:顺势疗法药品的稳定性评估并非基于药品上市时的同一容器密闭系统(21 CFR ...
|
|
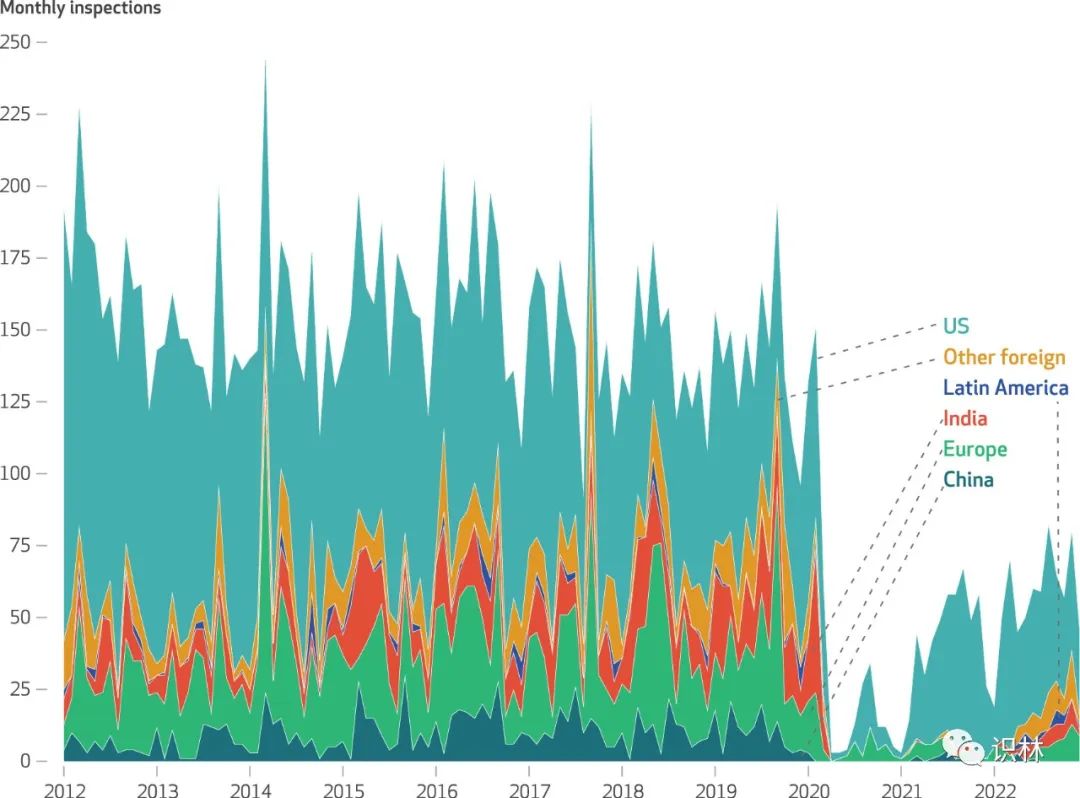
分析报告显示 FDA 对海外药品生产监管力度仍远低于...
2023.12.06
根据 12 月 4 日发表在《卫生事务》(Health Affairs)上的一篇题为“FDA 全球药品检查:对生产企业的监督仍远低于新冠(COVID-19)之前的水平”(FDA Global Drug Inspections Surveillance Of Manufacturing Establishments Remains Well Below Pre-COVID-19 Level...
|

|
国际药政每周概要:ICH Q5A(R2) 病毒安全性评价指...
2023.12.05
【监管综合】
11.29【ICH】Q5A(R2) 来源于人或动物细胞系生物技术产品的病毒安全性评价
【注册、审评、审批】
【创新研发与临床】
11.29【FDA】计算模拟揭示了鼻用喷雾剂分布的影响因素
11.29【WHO】首届 WHO 全球临床试验论坛提出了可持续的临床研究基础设施的全球愿...
|

|
FDA 对药物研发的特殊认定:孤儿药、快速通道、加速...
2023.12.05
在过去几十年中,美国国会授权 FDA 通过孤儿药(orphan)、快速通道(fast track)、加速审批(accelerated approval)、优先审评(priority review)和突破性疗法(breakthrough therapy)等五种特殊认定和审评途径,促进和加快对严重疾病的药物研发,以解决尚未满足的医疗需求。2023...
|

|
美国众议院委员会着手调查 FDA 对无效口服非处方鼻...
2023.12.05
美国众议院的一个小组正在调查 FDA 是如何允许非处方感冒药中的一个常见成分无效却在市场上存在数十年之久。去氧肾上腺素是非处方(OTC)感冒药中用于缓解鼻塞鼻胀的一种成分,而新数据表明该成分对于缓解鼻充血无效。
众议院医疗保健监督小组委员会主席、密歇根州共和党议员 Lisa McC...
|

|
国内药政每周导读:CDE修订变更受理审查指南,新增5个...
2023.12.04
【创新与临床研究】
12.1,【CDE】关于公开征求《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则》意见的通知
12.1,【CDE】关于发布《特应性皮炎治疗药物临床试验技术指导原则》的通告(2023年第58号)
12.1,【CDE】关于发布《新药临床安全性评价技术指导原则》的通告(20...
|

|
IPEM课程 CCS和无菌保证(第二课)
2023.12.04
以下文章来源于IPEM ,作者IPEM
无菌保证设计为系列课程:
第一课:主要介绍无菌产品的历史起源,探讨无菌保证的基础、理念和法规;污染控制策略 (CCS) 的核心理念和法规要求,以及在3个领域的实施和应用:湿热灭菌工艺、除菌过滤工艺、无菌工艺模拟试验。第一课已在今年8月开课,...
|

|
欧盟就GLP-1类药物可能存在的自杀自残风险向制药商提...
2023.12.04
欧洲药品管理局(EMA)在报告了胰高血糖素样肽-1(GLP-1)药物使用者的自杀和自残念头案例以及 11 月发布安全性信号后,于 12 月 1 日向这类药物的制药商提出了更多问题。
EMA 药物警戒风险评估委员会(PRAC)表示,其审查了有关该问题的临床试验、上市后监督和已发表的文献,...
|

|
【周末杂谈】新药和仿药间的利益平衡
2023.12.03
加强对《橙皮书》专利的监管,对仿药企业未必都是好事
11月7日,美国联邦贸易委员会(Federal Trade Commission, FTC)向 10 家药企发出警告,称将不再容忍新药企业滥用《橙皮书》专利制度、阻碍仿制药上市。FTC的做法甚是高调,用其自己网站上的说法就是用媒体发布的方式发警告信(War...
|

|
【识林新功能】识林AI助手上线试运行,期待与您共同探...
2023.12.02
识林AI搜索入口
识林AI对话入口
ChatGPT进入大众视野已经一年,国内大语言模型(Large Language Model, LLM)层出不穷,制药行业也已经有一些LLM应用出现,相信好学不倦的识林用户对此已不再陌生。
识林一直在关注,并不断探索将LLM的能力与识林知识库结合起来,为识林...
|

|
【轻松一刻】帮手,不是替手
2023.12.02
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转化为漫画,在识林平台上分享给大家...
|
|
FDA 发表计算模拟研究揭示鼻用喷雾剂分布的影响因素
2023.12.01
过敏性鼻炎 - 也称为花粉症 - 是一种非常常见的病症,作为吸入过敏原(例如灰尘或花粉)的人发生的炎症反应。症状包括鼻塞、鼻漏、喷嚏和瘙痒。缓解症状的一种治疗选择是使用喷雾装置将鼻皮质类固醇喷涂在鼻腔上。
在一系列模拟中1,美国 FDA 药品审评与研究中心(CDER)的研究...
|

|
英国生物银行最新推出 50 万人全基因组序列数据供研...
2023.12.01
英国生物银行(U.K. Biobank)于 11 月 30 日推出了最新的补充内容,来自 50 万人全基因组序列的数据现在可供全世界的研究人员使用。其目标是成为世界上最全面的健康数据资源。
生物银行成立 20 年来一直在建立自己的样品收集库,招募了 50 万名志愿者来提供有关他们的健...
|

|
FDA在2023财年发布的483缺陷项统计梳理
2023.11.30
本文从两个维度对FDA 483缺陷项进行统计梳理。一是2013-2023财年FDA 483各类别缺陷项出现频次和比例;二是对FDA在2023财年(2022年10月1日至2023年9月30日)发布的483中所涉及的所有缺陷项按照类别和出现频次进行了排序,从而帮助业界更清楚地了解FDA检查的最新关注点和GMP检查中最常出...
|

|
FDA 生物制品中心主任表示愿意使用单臂研究加速对罕...
2023.11.30
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 再次在公开场合主张对治疗罕见疾病的基因疗法使用加速审批。
他于 11 月 28 日在纽约大学 Grossman 医学院组织的网络研讨会上表示,FDA 正在“努力以患者为中心”,对加速审批更加灵活,并对将罕见疾病疗法推向市...
|

|
加拿大卫生部发布对PICS无菌附录的问答文件
2023.11.29
加拿大卫生部是PIC/S的成员之一,2018年采纳了PIC/S GMP无菌附录,并于2023年9月11号更新至最新版本。更新还包括一份无菌附录问答,问答对部分无菌附录的实施问题进行了说明。
无菌药品生产设施的主管是否需要有微生物学学位?
《食品和药品法规》C.02.029(b)要求“预期无菌...
|
|
FDA正在调查CAR-T治疗后发生T细胞恶性肿瘤的严重风险
2023.11.29
美国 FDA 于 11 月 28 日发布公告表示,正在调查 CAR-T 疗法是否会在极少数情况下导致淋巴瘤(一种血癌)。
FDA 表示,“虽然这些产品获批用途的整体获益继续超出其潜在风险,但 FDA 正在调查已确定的 T 细胞恶性肿瘤风险及所导致的严重后果,包括住院和死亡,并正在评估...
|

|
研究报告为 FDA 重建公众对疫苗的信任提供路线图
2023.11.28
根据黑斯廷斯中心最近发表的一份题为“确保 FDA 可信度以建立公众对疫苗的信任(Securing the Trustworthiness of the FDA to Build Public Trust in Vaccines)”的报告指出,美国 FDA 应采取一系列改革措施以重建在新冠(COVID-19)期间失去的公众信任。报告提出了 FDA...
|