
|
定义“未被满足的临床需求”成欧盟药品立法改革关键议...
2025.10.13
欧盟药品立法改革即将进入三边对话阶段,其中一项关键议题是“未被满足的临床需求”(Unmet Medical Need,简称UMN)的定义。在近日奥地利举行的2025欧洲健康论坛上,监管和行业专家们展开讨论,强调该定义将对制药行业研发方向、药品激励政策以及患者用药可及性产生深远影响。
定...
|

|
国内药政每周导读:中药注射液面临再评价,儿童药研发...
2025.10.13
【早期开发与临床】
10.11,【CDE】关于发布《儿童用药研发常见/共性问题及一般性答复》的通告
【CMC与仿制药】
10.9,【CDE】关于公开征求《化学仿制药生物等效性研究质量风险评估指导原则(征求意见稿)》意见的通知
10.9,【CDE】关于公开征求《碘131I化钠口服溶液仿...
|

|
【周末杂谈】诺华和 FDA 竟如此在法庭上强辩
2025.10.12
企业为商业利益而强辩可以理解,但政府在批准标签上放水确是少见
9月25日,美国华盛顿特区联邦巡回法院驳回了诺华对FDA的上诉。诺华指控FDA违法地批准了其治疗慢性心衰畅销药诺欣妥(Entresto)的仿制药,误在“缩减标签(skinny label)”上。企业与FDA打官司所形成的丰富法庭记录和法...
|

|
【听课心得】FDA 检查趋势与沟通策略:迎检及 483 ...
2025.10.11
FDA近期检查趋势与沟通策略:迎检及483回复实战案例
讲师:Chris Fanelli
时间:9月5-6日
地点:上海
9 月 5 - 6 日,IPEM 课程 “FDA 检查趋势与沟通策略:迎检及 483 回复实战案例” 在上海举办,由盛德律师事务所 FDA 业务团队 GMP / 监管合规首席合伙人 Chris F...
|

|
IPEM 课程 质量科学应用:偏差管理;无菌保证第三、...
2025.10.11
质量科学应用:AI时代,药品“更”为严格监管下的偏差管理
授课老师:李晓明
上课日期:10月16-17日(周四 - 五)
授课方式:中文
上课地点:北京
老师简介
李晓明博士,PSQ+公司创始人,曾就职于美国默克制药、美国礼来制药和浙江海正药业。在30余年制药生涯中...
|

|
2026财年 FDA 仿制药科研课题涵盖八大领域
2025.10.10
FDA于9月30日发布了《2026财年仿制药使用者付费法案(GDUFA)科学和研究优先事项》。
该文件基于FDA在2025年6月3日和4日举办的公开研讨会的公众意见,结合研讨会讨论意见以及业界评论,确定了八个优先研究领域,旨在借助GDUFA资金支持,由官方发起或支持前沿课题研究,进一步提升仿制...
|

|
FDA 官方开展的仿制药研究课题概要:定量方法与模型...
2025.10.10
在《2024财年GDUFA科学与研究报告》中,FDA利用内部资源和外部合作,在九大领域开展了超过70项研究课题,涵盖当前仿制药研发、审评以及监管科学的重大课题,旨在全面促进仿制药产品开发和可及。
如今的仿制药开发已不同以往,在质量和成本的双重压力下,我国仿制药企业有必要迎头赶上...
|

|
ICH 定稿 E2D (R1),指导上市后安全 ICSR 报告
2025.10.09
*封面截取自ICH官方培训材料 。
9月24日,ICH正式发布《E2D (R1) 批准后安全性数据:个例安全性报告管理和报告的定义和标准》指南,更新2003年发布的原ICH E2D指南。
随着新销售渠道的出现以及社交媒体等新信息源的广泛应用,原ICH E2D指南中的定义和监管指导已无法满足当...
|

|
89份 CRL 分析:一半仅因 CMC 或 GMP 缺陷被拒...
2025.10.09
识林曾报道FDA继首批公布已获批品种的202份完全回应函(CRL)之后,于9月4日再次公布89份(发布时间从2024年至2025年8月18日),且是FDA首次公布仍在审评中的药物的CRL。
现结合Pinksheet等多家外媒的分析文章,简述CRL中体现出的审评审批导向,供识林读者参考。
近期有一半新药仅因...
|

|
PMDA 进一步澄清生物类似药豁免日本人群数据
2025.10.08
9月底,日本PMDA发布了一份《关于在确认生物类似药与原研生物制品可比性中日本人群数据的处理的早期考虑》,旨在补充其在2024年1月发布的问答文件的相关内容,进一步澄清当前监管视角下处理日本人群数据以确认生物类似药与原研药相似性的原则。
日本曾要求至少进行一项包含日本受试者...
|

|
国内药政每周导读:获批前进口上市细则落地,CDE 上...
2025.10.08
【早期开发与临床】
9.29,【CDE】关于公开征求《药物上市申请临床评价技术指导原则(征求意见稿)》意见的通知
【CMC与仿制药】
9.30,【药典会】关于2025年版《中国药典》勘误的函
【经营准入】
9.30,【NMPA】关于境外已上市药品获批前商业规模批次产品进口有关事宜的公...
|

|
国际药政每周概要:FDA 拟优先审评本土 ANDA,PMDA...
2025.10.08
【早期开发与临床】
9.29,【PMDA】关于在确认生物类似药与原研生物制品可比性中日本数据的处理的早期考虑
9.29,【EMA】关于患者体验数据的思考性文件
9.30,【EMA】特发性肺纤维化(IPF)治疗药物的临床研究的最新指南概念性文件
9.30,【EMA】慢性乙肝(CHB)治疗药...
|

|
FDA 推出本土仿制药 ANDA 优先审评试点计划
2025.10.07
10月3日,FDA宣布启动一项新的ANDA优先审评试点计划,旨在激励药企在美国本土进行仿制药生产和研发的投资,强化美国药品供应链。
根据该试点计划,ANDA申请人如果在美国进行所需的生物等效性试验,并且其产品完全使用国内来源的API在美国制造,则有资格获得优先审评。
申请人可以通...
|

|
IPEM和识林祝大家中秋快乐!
2025.10.06
识林®版权所有,未经许可不得转载
...
|

|
【周末杂谈】印度正在经历一场严重药害事件
2025.10.05
咳嗽糖浆已致19人死亡,邦政府药品监管负责人遭停职,事件持续发酵
在我国举国上下欢度双节的幸福时刻,邻国印度正遭遇着一场严重的药品安全事件。截至昨天,已有19人因服用拉贾斯坦邦(Rajasthan)Kayson药厂生产的右美沙芬咳嗽糖浆(dextromethorphan hydrobromide,下图左)而死亡。...
|

|
【轻松一刻】天,地,人
2025.10.04
祝识林读者双节快乐!
轻松过佳节,认真做好药,与大家共勉。
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一...
|

|
辉瑞率先与特朗普达成最惠国定价协议
2025.10.03
9月30日,特朗普在白宫宣布与辉瑞(Pfizer)达成一项协议,后者承诺在美国市场的药品首发定价与国外同类经济体保持一致。
特朗普称这是秋季与多家大型企业达成的一系列协议中的首个。此前,特朗普曾威胁,若企业不自愿降低价格,政府将在9月底采取行政措施,以实现美国与国外药品定价...
|

|
美政府停摆中 FDA 靠企业缴费维持,但暂停受理申请
2025.10.02
当地时间10月1日,美政府正式宣告停摆关门。
此前FDA在政府停摆风险临近之际已有所准备。根据美国卫生与公众服务部(HHS)发布的计划,若联邦政府因资金中断而停摆,FDA的86%的员工,即13872人将继续工作,14%的员工约2316人将被强制休假。这一保留比例为近年最高,但实际保留人数...
|
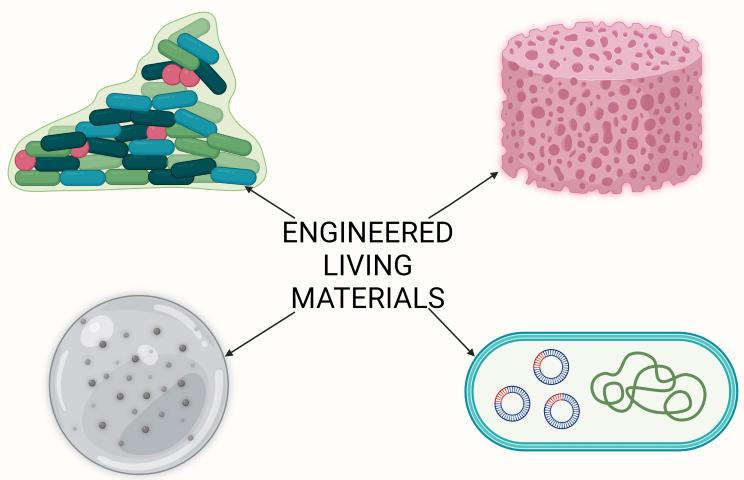
|
EMA 新天际线报告综述“工程活材料”(ELM)前沿进展
2025.10.01
识林读者,国庆中秋节日快乐!
长假期间,识林保持每日一文更新全球药讯,供您参考。
9月22日,EMA发布了一份关于工程活材料(Engineered Living Materials,ELM)用于原位(in situ)产生治疗成分的天际线扫描报告。
报告详细介绍了ELM的定义、分类、应用以及开发过程中面临的...
|

|
CDER 主任 Tidmarsh 发文谈临床试验报告透明度
2025.09.30
9月26日,上任不久的FDA CDER主任George Tidmarsh在FDA发布署名文章,强调其致力于提升临床试验报告透明度,确保研究可靠性。文中Tidmarsh还提及了自己参与的研究论文(早在其入职FDA之前)。这也许揭示了CDER新主任的未来的监管重点。
Tidmarsh表示,FDA一贯认为临床试验透明度是...
|