
|
AI 时代的制药行业知识管理,也许有机会不再“抽象”
2025.10.31
近日,国家标准委发布《知识管理实施指南 第2部分:制药》(GB/T 44651.2-2025),再次将“知识管理”这个熟悉而又陌生的概念带到大家面前。
该国标涵盖面较广,从组织环境、领导力、策划、支持、运行、绩效评价和改进等方面阐述知识管理体系。不过笔者特别关注的是工具和方法章...
|

|
FDA 官方开展的仿制药研究课题概要:数据分析与人工...
2025.10.31
在《2024财年GDUFA科学与研究报告》中,FDA利用内部资源和外部合作,在九大领域开展了超过70项研究课题,涵盖当前仿制药研发、审评以及监管科学的重大课题,旨在全面促进仿制药产品开发和可及。
如今的仿制药开发已不同以往,在质量和成本的双重压力下,我国仿制药企业有必要迎头赶上...
|

|
CDER 主任审视新药审批标准,批评“边际治疗”弊大于...
2025.10.30
FDA药品审评与研究中心(CDER)主任George Tidmarsh在10月27日的生物技术创新组织(BIO)患者倡导变革者活动中发表讲话,呼吁制药行业提高新药候选药物遴选标准,强调“边际治疗”(Marginal Treatments)可能弊大于利(does more harm than good)。
在经济学中,“边际”(Margi...
|
|
FDA 进一步澄清附加条件非处方药(ACNU)路径
2025.10.30
在10月份举办的RAPS Convergence 2025会议上,FDA官员向制药行业发出邀请,讨论使用新的非处方药审批路径:附加条件非处方使用(Additional Condition for Nonprescription Use,ACNU)的可能性。
FDA的ACNU最终规章于2024年12月发布,并于2025年5月27日正式生效,此前因特朗普...
|

|
全球药监亟需通用药品标识,ICMRA 发布工作进展
2025.10.29
近日,国际药品监管机构联盟(ICMRA)发布一份进展报告,简述当前全球药品标识(identifier)框架的进展。作为全球药监实现协同监管的努力方向,这项工作也值得走向全球的我国药企关注。
“此药是否彼药”?全球标识协调源自注册和变更需要
报告称,全球药品识别框架是为解决国际...
|

|
欧盟新药品法拟授予患者投票权,参与审批决策
2025.10.29
10月初,欧盟药品监管改革进程迎来关键节点,除了此前报道的“未被满足的临床需求”定义之外,患者在EMA监管活动中的决策权问题成为各方另一讨论焦点,其最终结果将对欧洲药品监管带来深远影响。
此次欧盟药品法规修订案涵盖广泛内容,包括激励特定领域药物开发、确保药品在欧盟成员...
|
|
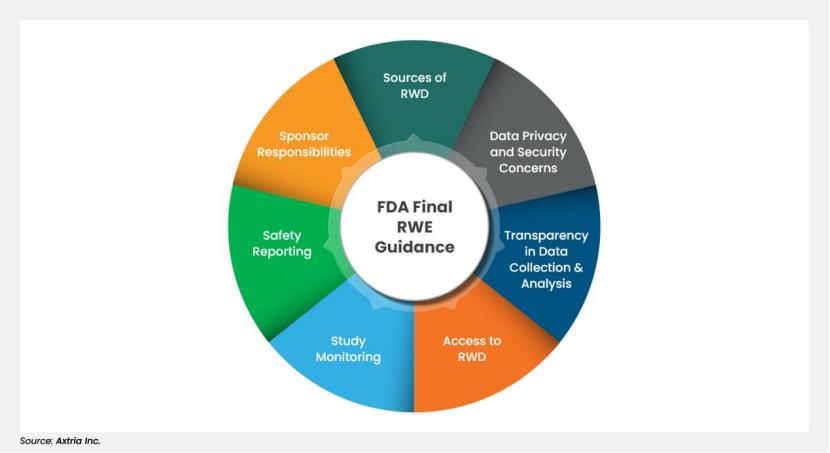
真实世界证据计划进展不易,FDA 拒绝大部分申请
2025.10.28
近日,FDA健康科学政策顾问Kristen Miller在由杜克-玛戈利斯健康政策研究所(Duke Margolis Institute for Health Policy)举办的研讨会上分享了FDA推进真实世界证据计划(Advancing RWE Program)的最新进展,并列举了申请被拒的常见原因。
该计划基于PDUFA VII,于2022年...
|

|
FDA 更新立卷审查拒收 MAPP,新增“检查清单”
2025.10.28
FDA于2025年10月23日发布并生效了政策程序手册(MAPP)《良好审评实践:立卷审查拒收》(MAPP 6025.4 Rev.1)。
该MAPP时隔七年更新,旨在为药品审评与研究中心(CDER)工作人员提供明确的政策、责任和程序,以开展对新药申请(NDA)、生物制品许可申请(BLA)及补充申请的立卷审...
|

|
国际药政每周概要:FDA 拒收申请的流程标准,PFDD ...
2025.10.28
【早期开发与临床】
10.23,【EMA】关于人用药安全性试验中的非人灵长类动物及3R原则实施的机会的思考性文件
10.22,【EMA】关于治疗溃疡性结肠炎的新药研发指南儿科相关更新的概念性文件
10.22,【EMA】关于治疗克罗恩病药品的临床研究指南儿科相关更新的概念性文件
10.22...
|

|
2025年 FDA 新药批准数量或创近年新低
2025.10.27
根据Endpoints统计,截至当前,FDA在2025年共批准了42种新药和生物制品,预计全年批准总数可能降至2022年以来的最低水平。尽管仍有多项新分子实体的审批决定将在年底前公布,但目前的审评节奏显示今年总获批数量或将低于近年水平。
作为对比,FDA在2024年共批准了69种新药与生物制品,2...
|

|
欧洲药典12.2版本更新内容概要
2025.10.27
欧洲药典(Ph. Eur.)自2025年发布第12版起仅提供在线形式,发布周期更新为年度版本3期(issue)发布。7月份公布了欧洲药典12.1,更新内容将于2026年1月1日起生效;10月份公布了欧洲药典12.2,更新内容将于2026年4月1日起生效。识林欧洲药典专题页面收录了欧洲药典12的通则目录、每...
|

|
国内药政每周导读:11批集采27日开标,粉液双室袋检查...
2025.10.27
【CMC与仿制药】
10.23,【NMPA】关于发布仿制药参比制剂目录(第九十七批)的通告(2025年第37号)
【生产质量】
10.20,【CFDI】关于发布《粉液双室袋产品检查指南》的通告
【经营准入】
10.22,【上海】关于公布第十一批国家组织药品集中采购企业相关信息的通知
【...
|

|
【周末杂谈】诺华与 FDA 和 MSN 的法律纠纷
2025.10.26
为一个仿制药打三起官司,其中一起可能影响专利政策的根基
两周前,本专栏讨论了诺华控告FDA违法批准慢性心衰药诺欣妥的仿制药,及在联邦法院和联邦巡回法院的败诉。其实,这起官司不仅是关于标签瘦身,还涉及化学成分。而且,在诺欣妥的成分上,诺华与印度仿制药公司MSN,还打着另外两起...
|

|
【识林小功能】我划重点大家看,同行笔记我来读
2025.10.25
识林会员们也许会在页面上发现许许多多的“-----”下划线,那其实是其他识林会员划的重点,点击还可能弹出同行们做的笔记,包括评论、心得或是疑问。
例如下面的图就截取自最新发布的《2025年9月识林全球药监法规指南导航》。
但会员们不仅可以看到别人的重点和笔记,也...
|

|
【识林主题词】新增基因编辑、临床试验方案、医药代表...
2025.10.25
— 主题词,是识林针对制药行业的关键概念,基于大量资料的综合分析,从定义、工作流程、法规指南、文献案例等多个维度梳理的系统知识纲要。截至目前,识林【主题词库】已上线超过1000个主题词,还在陆续增补当中。
— 从主题词入手,也是使用识林的最佳方式之一。主题词的系统性、全面...
|

|
疫情后数据可靠性缺陷增加了吗?研究分析1766封警告信
2025.10.24
近日,一项韩国学者的研究对2016年至2023年期间FDA发布的1766封警告信进行了分析,重点关注数据可靠性(Data Integrity,DI)相关违规行为在新冠疫情前后的变化趋势。
研究人员通过关键词筛选和上下文审查相结合的方式,从FDA公开数据库中检索并筛选出与数据可靠性相关的警告信,参考...
|

|
FDA 拟回归“通才”检查员培养模式
2025.10.24
美卫生部(HHS)官员向Pinksheet透露,FDA将开展一项“简单改革”(Simple Reform)计划,合并其所有药品、医疗器械和临床研究检查部门,将检查员转变为“通才”(generalists)。
这一举措将撤销2017年推行的“项目整合”(program alignment)计划所做的努力。该计划曾将检查员划...
|

|
交叉设计与美国人群难以兼得,礼来与学界呼吁 FDA ...
2025.10.23
FDA在8月发布新指南征求意见稿《肿瘤临床试验中总生存期的评估方法》中不仅强调总生存期(OS)的“金标准”地位,还建议肿瘤临床试验中的交叉设计“通常”应受到限制,与此同时,FDA又在着力推动增加美国患者在肿瘤试验中的参与度,近日,礼来肿瘤部门负责人Jake Van Naarden在媒体采...
|

|
艾伯维团队汇总分析去中心化临床试验案例
2025.10.23
艾伯维研究团队在9月份发表综述文章《真实世界证据时代的去中心化临床试验:近期经验的批判性评估》,该研究基于2010年1月至2024年3月期间的23项实际案例,对去中心化临床试验(DCT)的设计、实施、数据分析和结果解释进行了全面评估。
研究团队根据DCT的实施目的将其分为五类:别无...
|

|
MHRA 开发两个 AI 工具加速临床试验审评
2025.10.22
10月7日,英国MHRA发文称其通过重大流程改革和人工智能(AI)技术的应用,将临床试验审批时间缩短了一半以上。
根据《英国临床药理学杂志》(British Journal of Clinical Pharmacology, BJCP)最新研究,MHRA的IND审批时间从平均91天缩短至41天。过去一年,超过4600项IND申请中...
|