
|
英国 MHRA 远程药品 GMP 检查经验
2020.07.18
现场/远程混合检查或成新常态,远程检查不是万能药
英国药品与医疗保健产品监管机构(MHRA)正在借鉴以往病毒爆发的经验,推出了一项宏大的远程/现场混合检查计划,以帮助维持现有药品的供应并在 COVID-19 大流行旅行限制下批准新药,并且预计会在大流行结束以后成为新常态。
MHRA...
|

|
网课时代大数据:千门网课盘点
2020.07.17
150天超过1500门网课,从“很方便”,“正好利用疫情期间学习”,转变成“课好多,该听哪个?”,“太短了,没讲透”。行业未来需要什么样的网课,如何通过网课有效率的学习,识林尝试通过回顾这1500多门课,引起进一步的研究和讨论。
根据识林“会议日历”数据库,从春节后到7月初的1...
|

|
欧洲药品短缺:激励生产重返欧洲,摆脱对中国印度的依...
2020.07.17
欧洲议会环境、公共卫生和食品安全委员会(ENVI)最近通过了一项关于解决欧盟持续存在的药品短缺问题的草案报告,希望通过报告中的措施激励更多企业在欧洲生产并更好地协调欧盟成员国之间的关系。委员会于 7 月 14 日对报告草案进行了投票,79 票赞成,1 票反对,0 票弃权。最终报告...
|

|
线上讲座:FDA对美国本土外制药的监管未来
2020.07.16
COVID-19疫情加速了全球供应链新格局的转变。美国参议院最近召开了题为“COVID-19及后续:对FDA海外制药检查程序的监督”的听证会。听证会上有来自FDA高层(包括监管事务副局长,CDER监管项目副主任,以及全球政策和战略副局长)、政府问责署(GAO)以及行业高管的证词,目的是讨论FDA对...
|

|
FDA 宣布恢复国内检查,那么国外检查呢?
2020.07.16
7 月 10 日,美国 FDA 宣布了其准备从 7 月 20 日的那一周开始重启国内现场检查的目标。接受检查的美国区域应是在 FDA 的评级系统中显示 COVID-19 情况最为安全可以执行优先检查的区域。FDA 的评级系统基于州和国家数据评估了当地的 COVID-19 病例数。
评价级别基于...
|

|
与疫苗同样重要的小瓶:全球医用玻瓶制造火热加速
2020.07.15
随着科学家们竞相在新冠(COVID-19)疫苗开发道路上冲刺,为全球人口接种所需的数十亿医学级玻璃瓶和注射器生产的百团大战也在同时激烈上演。
与生产能够安全有效保护人们免受病毒侵害的疫苗所需的大量科学技术研发和临床试验相比,生产小瓶和注射器的工作看似平平无奇,但同等重要。...
|

|
FDA 或将拥有药品强制召回权,计划中国和印度突击检...
2020.07.15
美国 FDA 终于有可能在 2021 财年预算立法中获得其长期寻求的处方药和非处方药强制召回权。另外,还可能获得 500 万美元的拨款用于重启印度的突击检查试点计划,并在中国建立类似的计划。
民主党众议员 Sanford Bishop 在众议院提出了《2021 财年农业、农村发展、FDA 和相关...
|

|
WHO 对新冠疫情国际应对情况展开独立审查
2020.07.14
WHO 总干事谭德塞于 7 月 9 日在对 WHO 194 个成员方代表的网络会议上宣布对新冠(COVID-19)大流行的国际应对开展独立审查。
独立审查小组(称为大流行病防范和应对独立小组)将由前利比里亚总统、诺贝尔和平奖得主 Ellen Johnson Sirleaf 和新西兰前总理 Helen Clark...
|

|
国际监管机构商定新冠疫苗效力试验的严格标准
2020.07.14
国际药品监管机构联盟(ICMRA)最近的一次会议上商讨勾勒出候选新冠(COVID-19)疫苗进入后期试验之前应满足的标准,以及如何设计 III 期试验,应包括哪些人群等。
7 月 9 日 ICMR 举行网络研讨会上,各国监管机构建议 COVID-19 疫苗的 III 期试验应具有已确立效力的“严...
|

|
【一周回顾】2020.07.06-07.12
2020.07.13
识林推出 CAR-T 研发专题。WHO 发布瑞德西韦和地塞米松 BE 指南并邀请制药商提交药品评估意向书;公布在赛诺菲的 Priftin(利福喷丁)中发现亚硝胺杂质的情况。FDA 计划于本月恢复国内现场检查,发布四篇关于癌症临床研究资格标准的指南文件。欧盟发布人用药中的亚硝胺杂质评估...
|

|
FDA 四篇定稿指南扩大癌症试验特殊人群入组标准
2020.07.13
美国 FDA 7 月 10 日发布了四篇定稿指南,分别针对脑转移瘤患者、HIV或乙肝或丙肝患者、器官功能障碍或既往和并发恶性肿瘤患者、儿童患者人群的癌症试验资格标准给出了指导意见,并给出了针对将儿童患者纳入癌症试验的最低年龄考虑。
这些指南由 FDA 药品审评与研究中心(CDER)...
|

|
【周末杂谈】外行指导内行
2020.07.12
一份“外行”写的报告,导致美国57%的医学院关闭
两周前的“周末杂谈”提到普林斯顿高等研究院Flexner院长,未与爱因斯坦商量,就直接拒绝了罗斯福总统欢迎爱因斯坦去白宫做客的邀请。他还做过一件更非同寻常的事,那就是他在1910年发表的、长达346页纸的“美国和加拿大的医学教育”。...
|

|
抗结核药利福喷丁中发现亚硝胺杂质,来源与风险正在调...
2020.07.11
WHO 于 7 月 9 日公布了关于在赛诺菲的 Priftin(利福喷丁)中发现亚硝胺杂质的情况。WHO 预认证-药品评价小组(PQT/MED)基于 Priftin 在美国 FDA 的批准对该药进行了预认证。赛诺菲已暂停放行 Priftin 批次,同时正在考虑采取补救措施。WHO 指出,赛诺菲正继续就杂质问题与...
|

|
FDA 最新警告信显示溶剂回收商 GMP 合规困难重重
2020.07.10
美国 FDA 最近一封警告信值得制药企业和溶剂回收商关注,警告信揭示了有关原料药生产商保持溶剂回收的经济和环境效益而又不冒将潜在致癌杂质(例如,亚硝胺)引入药品风险方面的困难。
FDA 近日公布了其 6 月 17 日签发给印度 API 溶剂回收商 Vega Life Sciences 公司的警...
|

|
瑞德西韦:吸入剂试验启动,仿制药最低53美元一瓶,增...
2020.07.10
吸入溶液早期试验启动
吉利德(Gilead)于 7 月 8 日表示,已经开始对瑞德西韦(remdesivir)用于治疗新冠(COVID-19)的吸入溶液剂型进行早期测试。
吉利德表示,这一安慰剂对照试验将在美国招募约 60 名年龄在 18 到 45 岁的健康受试者,为进一步研究奠定基础,尤其是...
|
|
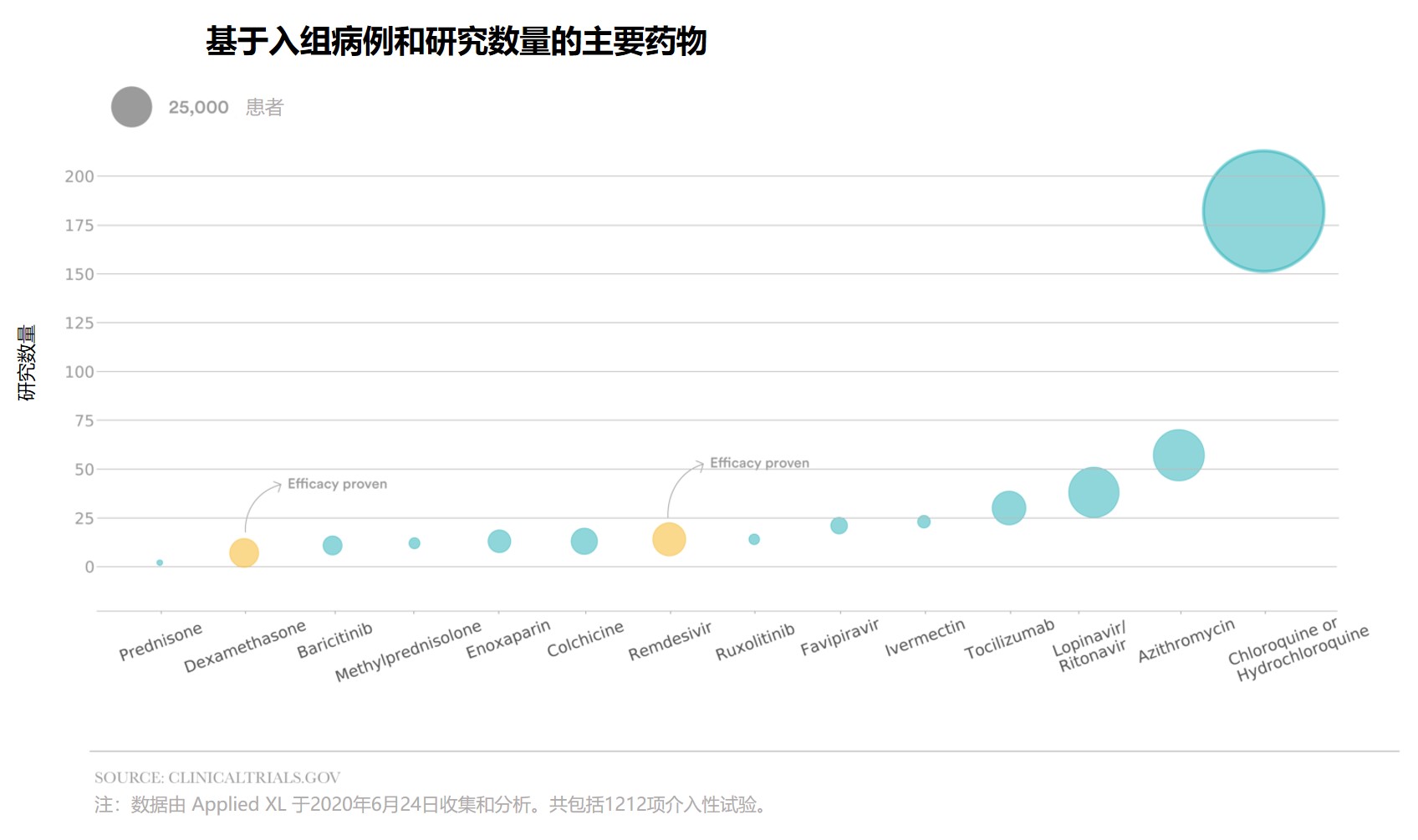
新冠药物临床研究:各自为战,缺乏统筹
2020.07.09
自今年新冠(COVID-19)爆发以来,研究人员针对 COVID-19 的治疗和预防措施设计了大批临床试验,雄心勃勃但混乱不堪,浪费了大量的财力和时间。
STAT 与 Newlab 公司下的 Applied XL 合作进行的一项分析发现,每六项临床试验中就有一项旨在研究抗疟疾药物羟氯喹或氯喹,而最...
|
|
WHO 计划发布细胞和基因疗法监管趋同白皮书
2020.07.09
WHO 计划很快发布白皮书,提出针对细胞和基因疗法的统一监管框架,促进中低收入国家的患者获得这些产品并增加商业可行性。美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 最近在由 PDA 主办的有关先进治疗药物产品的网络研讨会上如是表示。
Marks 在会上还讨论了将...
|
|
欧盟讨论疫情下药品供应的经验教训:协作,数据,生产...
2020.07.08
7 月 2 日药物信息协会(DIA)2020 欧洲会议上,与会者探讨了欧盟在大流行的头几个月中药品供应链方面的经验教训以及可能采取的确保将来可以更有效地解决供应问题和短缺的步骤。会上得出的一些结论和建议如下:
欧洲国家在冠状病毒大流行期间解决药品供应问题的方式分散,暴露了供...
|

|
FDA 发起多项研究了解处方药广告对患者和医生的影响
2020.07.08
标签和广告是药品监管的重要方面,且直接面向处方者和使用者(用户),只有准确了解用户通过标签和促销材料对药物的理解,才能更好地指导药品研发和监管,让制药商开发出来和监管机构批准的药真正实现预期用途。
美国 FDA 计划开展三项研究以评估处方药促销会如何影响医务人员和消...
|

|
药品申请数据化:抛弃 PDF,拥抱结构化持续更新数据...
2020.07.07
美国 FDA 最近数据策略现代化公开会议上,一个由多家制药公司发起的项目 — Accumulus 项目崭露头角。这一项目正在努力通过终止对“数字化纸质文件”(PDF 文件)的依赖来简化申请的提交和审评。
Accumulus 涉及创建一个平台,允许滚动数据流,而不是现在提交的在单个时间点的数...
|