
|
FDA 发布新网页展示如何执行检查
2024.03.21
近日,美国FDA 宣布推出一个新网页,展示如何使用其监督工具之一“检查”来帮助确保药品安全和质量。该页面重点介绍了FDA对药品质量的监督,概述了FDA监督药品生产商遵守CGMP要求的工作。页面包括有关 FDA 监管工具的信息,如警告信和 CGMP 检查后的行动。它还链接到 FDA 数据仪表...
|

|
FDA 发布中国产塑料注射器情况说明,对三家企业发出...
2024.03.21
美国 FDA 医疗器械与放射健康中心(CDRH)主任 Jeff Shuren 于 3 月 19 日发布声明通告有关 FDA 对中国产塑料注射器相关质量和性能问题的最新评估进展,警告公众除非没有其它选择,否则不要使用此类注射器。
FDA 最初于去年 11 月发布安全通讯,内容涉及 FDA 对某...
|

|
国际药政每周概要:欧盟新变更法规;FDA 阿尔茨海默...
2024.03.20
【监管综合】
03.15 【FDA】利用人工智能的潜力
03.11 【FDA】FDA 申请72亿美元用于提高食品安全和营养、促进医疗产品安全以及增强公众健康
【注册、审评、审批】
03.11 【EU】欧盟委员会提出新措施,以实现更好的药品许可生命周期管理
03.14 【FDA】FDA 批准...
|

|
欧盟药品法全面改革提案在欧洲议会获通过
2024.03.20
欧洲议会环境、公共卫生和食品安全委员会(ENVI)于 3 月 18 日以压倒性多数投票赞成改革现行药品法指令的提案,并通过了一系列修正案,将立法进程推进至下一阶段。
欧盟委员会于 2023 年 4 月提出了欧洲药品立法的一揽子改革计划,包括两项立法提案:一项新指令和一项新法规,...
|

|
美国国防部药品供应链风险报告强调海外产原料药风险
2024.03.20
美国一个两党参议院小组于 3 月 19 日公布了一封写给国防部长的信,要求其改善供应链安全,以尽量减少药品短缺,并减少对海外,尤其是中国生产的药品的依赖。
根据与信件一起公布的《国防部药品供应链风险报告》 (API)的中国制药商,要么来源不明。但根据报告,使用中国产 API ...
|

|
欧洲议会就药品立法改革提案进行辩论和投票
2024.03.19
欧洲议会卫生委员会定于 3 月 19 日就拟议药品立法的修订进行辩论和投票,包括与欧盟委员会去年发布的提案相比,修订的市场专营权和监管数据保护条款。
在辩论之前,议会环境、公共卫生和食品安全委员会(ENVI)发布了对欧盟委员会修订提案的折衷修正案。修正案包括领导立法修订过程的...
|

|
FDA 发布人工智能文件,强调跨部门合作
2024.03.19
美国 FDA 于 3 月 15 日发布了题为“人工智能和医疗产品:CBER、CDER、CDHR 和 OCP 如何合作”的文件,概述了在整个医疗产品生命周期中开发和使用人工智能的具体重点领域。
这份 7 页的报告是 FDA 生物制品审评与研究中心(CBER)、药品审评与研究中心(CDER)、器械与放射健...
|

|
FDA 发布仿制药受控通信新指南,厘清更多细节
2024.03.18
2024 年 3 月 15 日周五,FDA发布《与仿制药开发相关的受控函》定稿指南,这次发布的指南是对 2022 年 12 月指南草案的定稿,取代了 2020 年 12 月发布的指南。
与草案相比,定稿指南的变化包括更新指南以澄清受控通信中封面函的作用;澄清提交受控通信的授权代理人应包括...
|
|
FDA 专家会支持强生传奇生物的Carvykti和BMS的Abecma...
2024.03.18
美国 FDA 肿瘤药专家会(ODAC)于 3 月 15 日对两款 BCMA 靶向 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS)的讨论和投票结果已经出来,虽然两款药在各自的试验中显示出患者早期死亡的潜在问题,但专家们仍然认为这两个药的长期获益大于风险。
11名专家一致投票支持 ...
|

|
国内药政每周导读:上海探索生物药分段试点和长三角监...
2024.03.18
【CMC与仿制药】
3.12,【NMPA】关于发布仿制药参比制剂目录(第七十八批)的通告(2024年第11号)
【注册与审评审批】
3.17,CDE 药品审评报告和说明书更新,其中包括下列国产新药
【GXP与检查】
3.11,【四川省】关于公开征求《四川省药品生产许可快速审查审批实施...
|

|
【周末杂谈】标签与监管 – 处方药与 OTC 药
2024.03.17
药品监管的松紧,要与药品的使用联系起来看
处方药和非处方药(OTC),哪个监管得更严?对这个问题的回答,几天前,对笔者来说是显而易见的:当然是处方药严了。新药上市后多年,经过或不经过仿制药阶段,当其安全性和有效性得到了充分确认后,经企业申请和FDA批准,才能成为OTC药。而且O...
|

|
【识林新功能】识林变更管理工具上线试用
2024.03.16
https//lib.shilinx.com/index.php/moc/index/home 识林变更管理工具入口
2024年7月4日更新国内变更指南中的情形,包括中药上市后药学,疫苗上市后药学,化药原料药变更问答。
药品生命周期,离不开变更;而变更流程之重,莫过于分级。
“这个变更,到底该是微小...
|
|
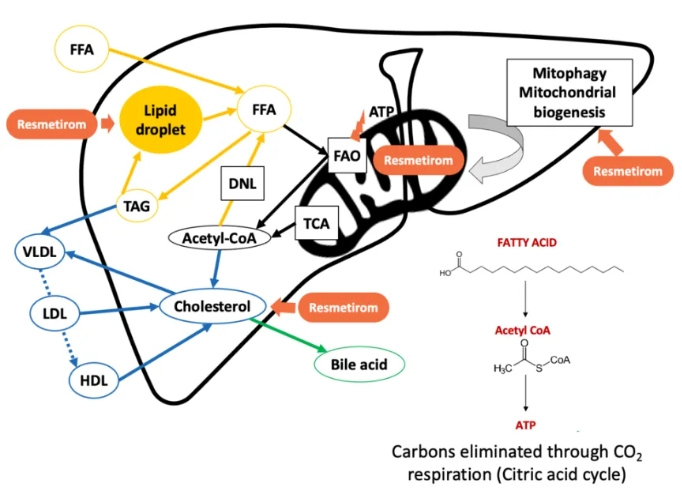
FDA 批准首个代谢功能障碍相关脂肪性肝炎药物
2024.03.15
美国 FDA 于 3 月 14 日加速批准了 Madrigal 药业 的 Rezdiffra(resmetirom)用于治疗中度至重度肝脏疤痕(纤维化)的成人代谢功能障碍相关脂肪性肝炎(MASH),也称为非酒精性脂肪性肝炎(NASH),结束了该病长达数十年没有有效治疗方式的现状。
FDA 药物审评与研究中心(CD...
|

|
欧盟委员会颁布法规简化变更流程,取消生物制品质量和...
2024.03.15
欧盟委员会(EC)于 3 月 11 日颁布授权立法,通过修订对上市许可变更法规的来改善药品生命周期管理。
欧盟立法者上次对变更监管框架进行重大修订是在 2012 年。委员会表示,自那时以来,总体变更数量增加,“耗尽了监管机构和行业的资源”。工作量的增加与进展相一致,这表明“...
|
|
FDA 公布2025财年预算提案,提出扩大检查和数据收集...
2024.03.14
美国 FDA 于 3 月 11 日公布了其 2025 财年 72 亿美元的预算提案,其中 37 亿美元的财政拨款,35 亿美元来自使用者付费资金,总体比 2023 财年的资金水平增加了 4.95 亿美元。根据最近公布的 2024 财年最终资金,预算提案比 2024 财年增加了 1.68 亿美元。
FDA ...
|

|
FDA 关注强生传奇以及BMS两款CAR-T骨髓瘤试验中的早...
2024.03.14
美国 FDA 将于 3 月 15 日召开肿瘤药专家会(ODAC)讨论两款 CAR-T 疗法研究的早期患者生存率的负面趋势“在临床获益的背景下是否可以接受”。
根据 FDA 为专家会准备的简报文件,FDA 对两项旨在将 CAR-T 疗法 Carvykti(强生/传奇生物)和 Abecma(BMS) 纳入多发...
|
|
FDA 更新早期阿尔茨海默病药物开发指南,增加对生物...
2024.03.13
美国 FDA 于 3 月 11 日发布“早期阿尔茨海默病:治疗药物的研发”修订指南草案,描述了 FDA 目前关于使用生物标志物来选择患有早期阿尔茨海默病参与者参加试验的想法。
该指南草案是 FDA 于 2018 年 2 月发布草案的修订版,是为考虑开发用于患者发展为明显痴呆之前的散发...
|

|
FDA 发布非处方药 NDA 和 ANDA 的年度报告标签变...
2024.03.13
美国 FDA 于 3 月 12 日发布了一篇题为“非处方药(OTC)新药申请(NDA)和简化新药申请(ANDA)可年度报告的标签变更”指南草案,就可能在年度报告中提交的 OTC NDA 和 ANDA 产品标签变更类型提供了建议。
FDA 批准 NDA 或 ANDA 后,申请人可以对已批准的申请进行变更,...
|

|
国际药政每周概要:欧盟卫生技术评估,DARWIN EU 真...
2024.03.13
【监管综合】
03.05【EU】关于实施欧盟卫生技术评估法规的公众意见征询
03.07【EMA】DARWIN EU®继续扩大其提供真实世界数据研究的能力
【注册、审评、审批】
03.04【FDA】MAPP 6025.6 Rev.1 审评质量管理规范:突破性治疗认定药品和生物制品的管理
03.04【FDA】MAPP ...
|

|
FDA 要求召开外部专家会讨论礼来阿尔茨海默药 donane...
2024.03.12
礼来于 3 月 8 日表示,美国 FDA 将召开外部专家会讨论其阿尔茨海默病药物 donanemab 是否应该获得批准。
Donanemab 在去年的 III 期试验中取得了成功,与安慰剂相比,阿尔茨海默病的进展速度减缓了 35%。但礼来表示,FDA 预计将召开专家会来审查该试验,并表示,FDA“希望进...
|