
|
加速批准有望加速撤销?GSK在确证性试验失败后迅速撤...
2022.11.23
葛兰素史克(GSK)于 11 月 22 日宣布,应美国 FDA 要求,GSK 正在从美国市场撤出 Blenrep。在此之前,GSK 刚刚于 11 月初宣布 Blenrep 在治疗此前至少接受过两线治疗的复发或难治性多发性骨髓瘤方面,效果不及百时美施贵宝(BMS)的 Pomalyst 和地塞米松联合治疗方法。
...
|

|
FDA 似正收紧加速审批要求:申报时需完成确证性试验...
2022.11.23
美国 FDA 似乎已经默默地开始对加速审批项目进行改革。
ADC Therapeutics 公司于 11 月 8 日在其第三季度收益报告上表示,“在 FDA 提供了强有力的指导,使其重新考虑加速审批路径之后,公司正回过去重新评估其实验性靶向 CD25 的新型抗体偶联药物(ADC)Cami(camidanlumab tesi...
|

|
国际药政每周概要:欧盟GMP附录11计算机化系统修订概...
2022.11.22
【注册、审评、审批】
11.17【FDA】FDA 批准首个可延缓1型糖尿病发作的药物
11.18【EMA】评估生物物质新活性物质(NAS)状态需考虑的标准思考性文件
【创新研发与临床】
【GxP 与检查】
11.17【PIC/S】药品 GMP 附录11计算机化系统修订概念性文件
11.16【EMA】药...
|

|
FDA 要求提交风险管理计划,企业表示你越界了
2022.11.22
美国 FDA 于今年 5 月份发布了一份题为《减轻潜在药品短缺的风险管理计划》指南草案,要求相关原料药(API)、制剂和医疗器械生产商提交风险管理计划(RMP),以避免药品短缺。但制药行业利益相关者认为,FDA 这一要求超出了其法定权限。
根据提交的反馈意见显示,制药商们还认为...
|

|
国内药政每周导读:审评计时规范,海南真实世界研究,...
2022.11.21
【创新药与临床研究】
11.14,【CDE】关于发布《双特异性抗体抗肿瘤药物临床研发技术指导原则》的通告(2022年第40号)
11.16,【CDE】关于公开征求《慢性肾脏病治疗药物临床试验技术指导原则》意见的通知
11.16,【CDE】关于公开征求《狼疮肾炎治疗药物临床试验技术指导原则...
|

|
FDA 发布指南草案详细说明非处方药专论使用者付费法...
2022.11.21
美国 FDA 于 11 月初发布了《评估非处方药专论使用者付费(OMUFA)计划下的使用者付费》指南草案,提供了有关 OMUFA 计划中有关收费的各个方面信息。
指南草案介绍了 OMUFA 收费的类型、收费截止日期,某些收费的例外情况,交费的程序,未能支付所需费用的后果以及退款、费用争...
|

|
【周末杂谈】说什么与怎么说
2022.11.20
如何有理有据地呼吁FDA制定监管政策的具体实例
如何有效地与国外药监部门交流,尤其是与FDA交流,由于文化和社会的背景不同,是我国出口药企多年来面临的挑战。聘请国外咨询师、咨询公司或律所,是惯常的做法。原则上讲,解决问题就好,管它是第三方还是第四方呢。但对那些不甘于此,...
|

|
【识林社区】优质问答集锦7:设备验证,仓储,方法转...
2022.11.19
识林社区,目前向全部识林用户免费开放。
大家登陆注册后,就可提问与回答。识林社区详细介绍请见文末
识林邀请了许多来自企业一线的专业人员,作为识林的“向导”,回答大家的疑问。
以下是近期来自向导的优质回答,供大家参考探讨。
Q1. 如何开展设备、设施的定期审...
|

|
【识林问答短视频】生物制品配液,共线评估,除菌过滤...
2022.11.19
识林提倡“知识导向”,严肃地阅读,系统性听课,需要投入大量时间,从而获取认知层面的提升。当然,企业用户提升认知的目标,还是解决更多、更复杂的问题。
在“问题导向”方面,【识林社区】在向导老师们的支持下,努力做到“有问必答”,而【识林问答短视频】则是从识林数...
|

|
欧盟发布关于修订《GMP附录11计算机化系统》指南的概...
2022.11.18
欧盟《GMP附录11计算机化系统》现行版本指南于2011年发布,至今已施行十余年,期间新理念和新技术均取得广泛发展,指南在新旧领域将不能提供足够的指导和监管期望。2022年11月16日,欧盟发布关于修订该指南的概念文件,于2022/11/16/ ~ 2023/01/16期间向业界征求意见。并拟议在2024...
|

|
FDA发布49篇BE指南,新增杜氏肌营养不良症等重要疾病...
2022.11.18
美国 FDA 于 11 月 17 日发布了新一批 49 篇具体产品指南(PSG),为仿制药开发和生成支持简化新药申请(ANDA)批准所需的证据提供建议,从而帮助简化仿制药开发和 ANDA 审评,促进仿制药竞争。
这一批 49 篇具体产品指南包括:29 篇新增和 20 篇修订。32 篇(其中 20...
|

|
线上讲座:细胞治疗产品生产用物料的选择要点与评价
2022.11.17
起始物料和原料的质量是药品生产时要考虑的关键因素。对于细胞治疗产品而言,由于起始原材料(如生产用细胞)的特殊性和工艺的复杂性,对细胞治疗产品的生产和质量管理带来较大的挑战。因此,在细胞治疗产品的质量控制策略中需要着重考虑起始原材料的变异性、生产工艺的复杂性以及生产批...
|
|
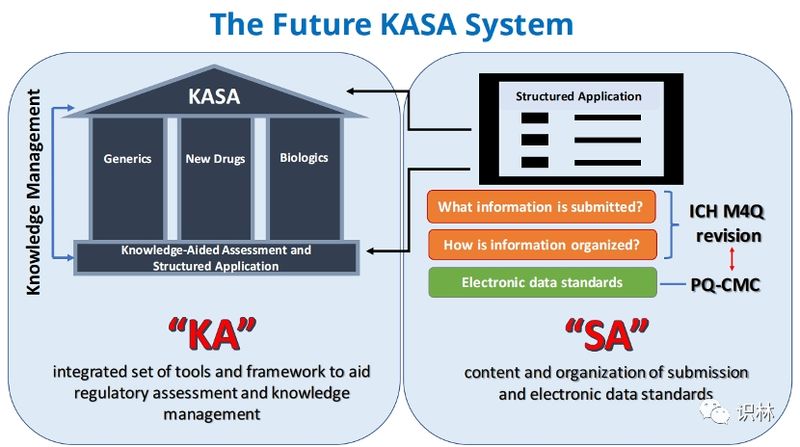
从FDA课件截图窥见KASA真面目,思考未来数字化审评的...
2022.11.17
近年来,FDA每年都有至少一次在公开会议上全景展现KASA(Knowledge-aided Assessment and Structured Application,知识辅助评价和结构化申请)的现状与进展。去年是在第5次FDA/PQRI(Product Quality Research Institute,药品质量研究学会)联合会议上(识林作了要点报告),今年...
|
|
业界呼吁 FDA 制定针对复杂仿制药的批准后变更指南
2022.11.16
最近召开的普享药协会 GRx+Biosims 会议的一场闭幕小结会议上,来自美国 FDA 和行业的人员讨论了复杂仿制药的批准后变更问题。
FDA 提供的 GDUFA II 年统计数据显示,略高于 74% 的需事先批准补充申请(PAS)和近 94% 的生效变更(CBE)-30补充申请在首轮获得批准。...
|

|
罗氏阿尔茨海默药 gantenerumab 两项3期临床试验失...
2022.11.16
瑞士制药商罗氏于 11 月 14 日披露,其抗淀粉样蛋白药物 gantenerumab 在两项早起阿尔茨海默病 III 期试验中失败,不仅没有达到减缓临床衰退的主要终点,β-淀粉样蛋白的去除水平也低于预期。
罗氏在新闻稿中表示,与安慰剂相比,gantenerumab 分别减缓了 8% 和 6%...
|

|
国际药政每周概要:FDA仿制药活性成分相同性评估指南...
2022.11.15
【注册、审评、审批】
【GxP 与检查】
11.09【MHRA】恢复国际 GMP 检查
【CMC 与仿制药】
11.08【FDA】指南草案 ANDA中的相同性评估 — 原料药
11.08【FDA】仿制药计划月度绩效活动报告(2022财年)更新
【ICH 实施】
【监管综合】
11.10【WHO】WHO, ...
|

|
FDA 表示生物类似药生产场地更需要现场检查而不是远...
2022.11.15
美国 FDA 药品审评与研究中心(CDER)首席副主任 Jacqueline Corrigan-Curay 在前不久普享药协会(AAM)举行的 GRx+Biosims 会议上表示,对于生产生物类似药的工厂,将会执行现场检查而不是远程评估,因为这些产品相对较新,并且涉及到新颖的生产工艺。另外,会上还讨论了生物类...
|

|
国内药政每周导读:新药获益-风险评估,药品注册期间...
2022.11.14
【创新药与临床研究】
11.08,【CDE】关于公开征求《儿童抗肿瘤药物临床研发技术指导原则》意见的通知
11.08,【CDE】关于公开征求《新药获益-风险评估技术指导原则》意见的通知
【药学研究与仿制药】
11.08,【CDE】关于发布《化学仿制药口服调释制剂乙醇剂量倾泻试验...
|

|
FDA 2022 财年仿制药批准数据趋势与分析
2022.11.14
美国 FDA 仿制药办公室(OGD)最近更新了 2022 财年全部仿制药使用者付费(GDUFA)批准和接收数据。2022 财年 FDA 共完成 722 件简化新药申请(ANDA)完全批准,比去年多出 43 件,但也不及前几年,比 2019 财年创造了历史最高批准记录的 935 件更是少了 213 件。原始 ANDA...
|

|
【周末杂谈】咬文嚼字:临床试验与临床研究
2022.11.13
公开临床试验数据,借助社会资源,了解药品的真实疗效
ICH E6(R2) GCP指导原则说:“The terms clinical trial and clinical study are synonymous”,即临床试验和临床研究是同义词。笔者以为这个说法是狭义在GCP范畴内的,反映了ICH本身的注册偏向性,及产业界的利益所在...
|