
|
FDA 公告对一家药商伪造文件的惩处
2019.08.22
美国 FDA 于 8 月 20 日在其新闻公告中表示向一家中国非处方药(OTC)制药商发出了一封警告信,内容涉及包括数据可靠性在内的 CGMP 违规行为。这是 FDA 不太常见地通过新闻公告和邮件订阅的形式公布其向某家公司发出警告信,宣传力度之大或许与公司所生产的产品性质有关,FDA ...
|
|
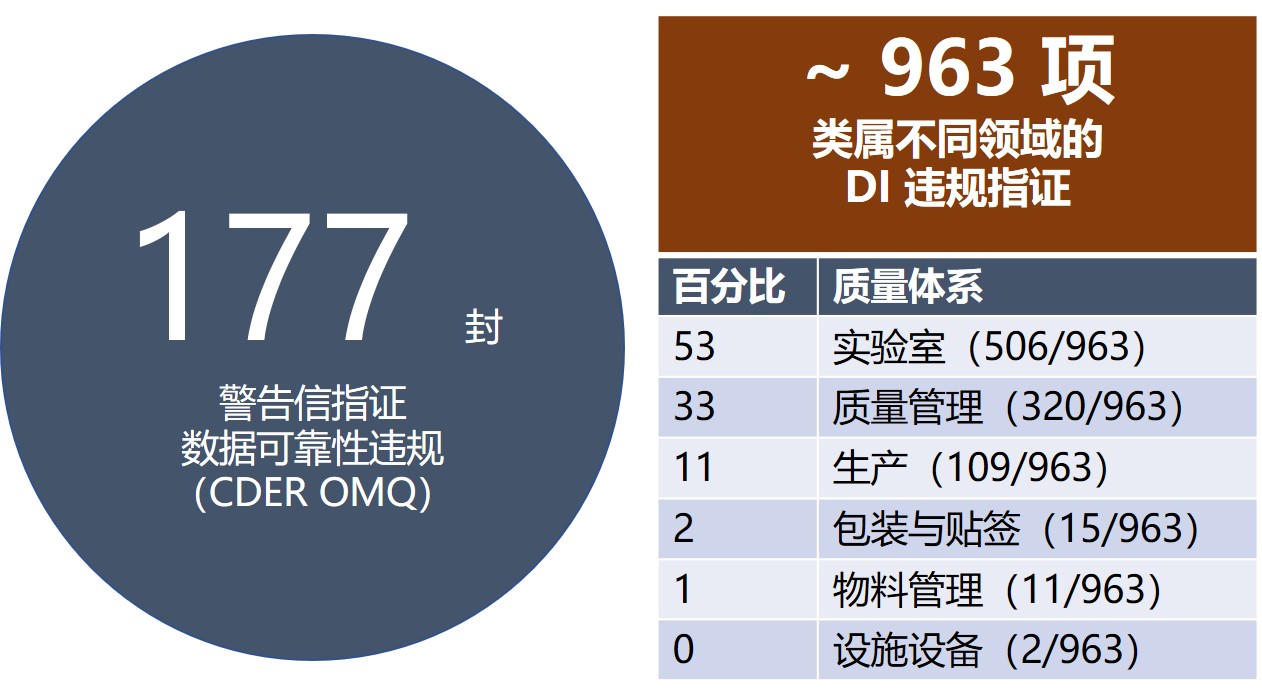
FDA 向国外发出的警告信四分之三涉数据可靠性
2019.08.13
昨天的资讯介绍了企业如何换个角度从监管视角审查自身问题,在监管检查之前发现隐藏的数据可靠性缺陷。今天我们从一些警告信观察项数据以及资深专业人士的建议来继续看看如何及早、高效的发现数据可靠性问题。
前 FDA 检查员、Parexel 咨询公司副总裁 Ron Tetzlaff 于 2019 年...
|

|
当 CMO 收到警告信时,你该怎么办?
2019.07.24
当你作为一家制药商,寻找到一个合适 CMO,并且完成了前期的调查、审计、技术转移、变更申报等一系列准备工作,就要开始生产或者已经开始生产了,此时你的合同商收到了警告信,你会如何反应,又该怎么办?
背景
你作为药品上市申请的持有人,刚刚对你所拥有的商业销售药品完成了向...
|

|
Akorn 因根源调查不力再收 FDA 警告信
2019.07.12
美国 FDA 于 6 月 13 日发给 Akorn 公司的警告信中指证公司对杂质和瓶子缺陷问题执行了错误的根源调查,无菌操作不良以及对计算机设备控制不足。Akorn 的警告信显示了一种趋势,即,FDA 在企业超标(OOS)调查中发现越来越多的 GMP 违规行为,这一问题正有逐渐取代数据可靠性成为...
|

|
数据可靠性危机导致 Apotex 撤销 31 件已获批 AND...
2019.07.11
加拿大制药商 Apotex 公司因其在印度班加罗尔的两家工厂持续存在数据可靠性和质量部门失效问题,而要求撤销美国的 31 个获批仿制药申请。美国 FDA 于 7 月 10 日在联邦公报上发布撤销通告,并列出具体撤销名单。
Apotex 公司撤销仿制药申请的决定是近年来数据可靠性危机所...
|

|
FDA 连发警告信加强对原料药再包装商的监管
2019.07.05
从最近分别签发给三家原料药再包装商的警告信中,美国 FDA 对供应链透明度的担忧可见一斑。三家再包装商都未能向其客户披露原料药原始生产商的名称,这种做法曾是原料药行业的常见操作,但 FDA 现在希望叫停这种做法。
这三家再包装商均位于美国境内,分别是科罗拉多州 Englewood ...
|

|
设备没清洗?工人欢度假期去了
2019.06.01
警告信是掌握美国FDA的CGMP合规要求和趋势的重要学习资料,不仅包含制药企业不该触碰的合规“红线”,还警示企业遇到问题不该采用的错误解决思路。但今天我们选出的这封警告信却有着搏君一笑的作用,其中的缺陷项并不独特,但是企业的解释却令人称奇。
这是一封美国 FDA 于 5 月 2...
|

|
FDA 因 GMP 违规对顺势治疗产品公司发布警告信
2019.04.04
由于严重违反 GMP,美国 FDA 于 4 月 1 日向四家顺势治疗(homeopathic)药品制造商发布警告信【Tec Laboratories Inc、 Red Mountain Inc、 King Bio Inc.、 B. Jain Pharmaceuticals Private Limited】。警告信包括一家反复违法的公司,FDA 之前已经警告过其重大 CG...
|

|
FDA 宣布启动供应链安全试点计划并向大型供货商开刀
2019.02.15
美国 FDA 于 2 月 7 日宣布接受来自制药行业及其供应链合作伙伴的申请参与供应链安全试点计划,以测试用于在整个供应链中追溯跟踪处方药的产品标识符、条形码和互操作系统的使用。
《药品供应链安全法案》(DSCSA)于 2013 年 11 月 27 日签署成为法律,概述了构建可以识别...
|

|
FDA 谈数据可靠性及其与质量文化的关联
2018.10.24
美国 FDA 官员最近对美国和欧盟执法行动的分析显示,在全球监管机构质疑产品质量开始打击数据可靠性(data integrity)问题数年之后,这一问题继续困扰着制药行业。
FDA 药品审评与研究中心(CDER)合规办公室部门主管 Carmelo Rosa 上个月在普享药协会(AAM)主办的 GRx+Biosi...
|

|
FDA 官员总结 2018 年警告信趋势
2018.10.17
美国 FDA 药品审评与研究中心(CDER)生产质量办公室代理主任 Francis Godwin 在 9 月 25 日举行的 PDA/FDA 联合会议上讨论了一些推动警告信发布的最新趋势,并分享了最近警告信中的例子来说明检查员发现的一些缺陷。
Godwin 表示从今年 1 月到 8 月 31 日,FDA 生产...
|

|
警告信中关于培养基模拟灌装的合规风险详解 -- 如...
2018.05.31
识林警告信数据库上线了
警告信是掌握美国FDA的CGMP合规要求和趋势的重要学习资料,不仅包含制药企业不该触碰的合规“红线”,还警示企业遇到问题不该采用的错误解决思路,和应有的正确方式。
每封警告信都包含值得学习的内容,但逐一阅读存在重复阅读和挂一漏万的风险。系统...
|

|
美国FDA警告信趋势解析
2018.05.10
从2013年至2018年第一季度,美国FDA共发出233封与药品GMP相关的警告信(不包括药房配药/compounding相关)。
中美印三足鼎立,中国后来居上
按被警告企业所在国家地区看,前五位是印度56封,美国53封,中国51封,韩国10封,加拿大9封,其它国家地区一共54封。
从2016年第...
|

|
FDA承诺药品GMP警告信将更迅速简短
2016.07.19
FDA药品GMP警告信将更加简短而要点分明,并将更加迅速地发布。FDA正在编写更加简短的药品GMP警告信以期更迅速地发布出来。FDA正更少的依赖警告信而是更多的依赖合规指南文件传达合规建议来完成这些工作。
FDA关于检查观察项方面正式通知和反馈的延迟,成为业界理解FDA对于其运行的担忧...
|

|
关于无标题信,FDA与国会的冲突
2015.08.29
p1=国会质疑FDA对无标题信使用和公布
美国FDA对违反《食品药品化妆品法案》的企业,采取的通知行动(advisory actions)包括警告信和无标题信(Untitled Letters);如果企业没有及时恰当纠正,就会导致执法行动。FDA的《监管程序手册》(Regulatory Procedures Manual)明确...
|

|
印度Marck Biosience公司收到FDA警告信
2014.08.21
Marck Biosciences公司曾为美国市场生产无菌产品。目前尚不清楚该公司是否拥有欧盟GMP认证。EudraGMDP既没有列出GMP认证也没有GMP不符合报告。但因数据库还不完整,并不是所有国家均将数据输入欧盟数据库。
今年3月,美国FDA发布针对Marck Biosciences的进口禁令。目前,FDA对此作出...
|

|
【IPEM】6月课程:制剂处方与工艺研究—郑玉群
2014.06.09
郑玉群博士自07年IPEM项目创立伊始,就给IPEM的学员们授课,郑老师可以说是IPEM的金牌授课老师,他的课我有幸听过多次,每次都有新的收获。在刚刚过去的IPEM2014年6月课程中,制剂处方开发、工艺开发的内容依旧精彩,受到众多从事固体制剂研发和生产的同学的欢迎,而且药审中心的几位审评...
|

|
华海制剂销售美国获益
2013.08.16
2013年1月18日,华海的美国合作伙伴Par Pharm拉莫三嗪缓释制剂的ANDA申请获FDA批准(在这之前获批的分别是Anchen 2012年12月26日,Wockhardt 2013年1月4日)
2013年4月27日,华海发布于制剂产品拉莫三嗪美国市场收益情况的公告,获得该产品一季度销售的利润分成约5335万元人民币
2013年...
|