|
FDA 优先审评和竞争性仿制药申报与审批数据回顾
2021.01.28
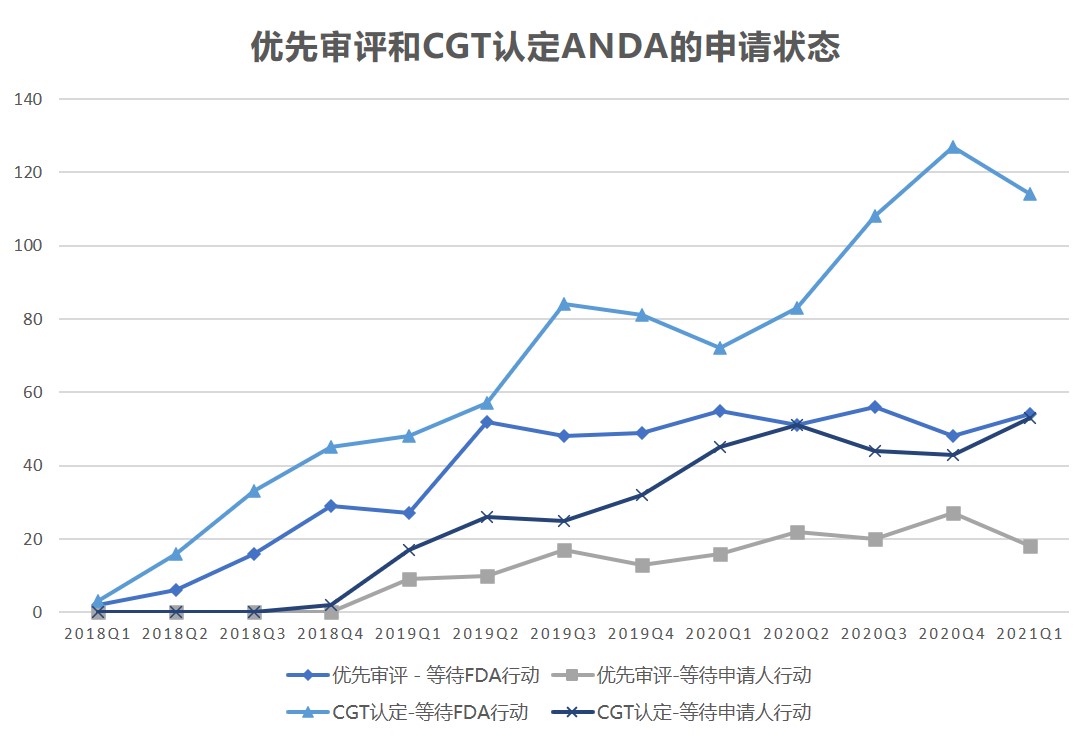
美国 FDA 仿制药使用者付费计划 II 期(GDUFA II)实施已有三年的时间,从过去三年的数据看,FDA 批准或正在审评的优先和竞争性仿制药(CGT)简化新药申请(ANDA)正在增加。
根据 2017 年 FDA 重新授权法案(FDARA),其中关于 GDUFA 重新授权的部分包括了在优先审评计划下对...
|

|
FDA公布2021财年GDUFA费率,申请费上涨场地费项目费下...
2020.08.03
美国 FDA 于 7 月 31 日宣布了仿制药使用者付费项目(GDUFA)II 期第四个年头 — 2021 财年(2020 年 10 月 1 日至 2021 年 9 月 30 日)的费率。申请费(无论是 ANDA 还是 DMF 申请费)是唯一上涨的费用类别,且涨幅显著。场地费和项目费均有所下降,相比 2020 ...
|

|
仿制药申请人与 FDA 的正式沟通方式汇总
2020.04.30
为了弄清监管部门的意图,企业内部会开展多少讨论试图在 FDA 发布的指南、幻灯片,甚至在具体产品的信息请求或完全回复函中准确解释 FDA 的想法?虽然 FDA 会竭尽全力持续更新当前的指南文件并不断发布新指南,以解决从企业收集到的常见问题,以及其在申请审评中看到的常见缺陷趋势...
|

|
FDA公布2020财年GDUFA费率,项目费大幅下降
2019.07.27
美国 FDA 于 7 月 26 日宣布了 GDUFA II 期第三个年头 — 2020 财年(2019 年 10 月 1 日起至 2020 年 9 月 30 日止) 的费率,大多数收费类别均有所下降,其中项目费降幅最大,下降了近 11%,相当于为大公司节省了二十万美元。
另外,由于 FDA 在设定 20...
|

|
FDA 发布完全回应函后会议定稿指南
2018.12.08
美国 FDA 于 12 月 3 日发布了关于 FDA 和 ANDA 申请人之间帮助澄清缺陷的 30 分钟完全回应函(CRL)后会议定稿指南。根据 GDUFA II 目标,FDA 将在接收会议请求 10 天内为 90% 的 CRL 后会议提供会议安排,如果会议请求获得批准,将在 30 天内(或应申办人要求在...
|

|
FDA 公布 2019 财年 GDUFA 费率
2018.07.27
美国 FDA 于 7 月 26 日在https//www.federalregister.gov/documents/2018/07/27/2018-16067/generic-drug-user-fee-rates-for-fiscal-year-2019 联邦公报上公布了 2019 财年仿制药使用者费,其中包括申请费、DMF 费和不同类型的场地费以及项目费。虽然大多数费用仅...
|

|
FDA首次公布仿制药审评时长:收费几百万,还等三年半...
2018.03.16
FDA 3月14日发布了第一份GDUFA II季度绩效报表。这份报告是基于GDUFA II目标中新增加的“强化绩效量化和汇报”的工作板块发布的,当中有一些我们以前从没有看到过的绩效指标,其中,最引人注目的就是ANDA批准的平均时长和中位时长。这份报告显示,2018财年一季度(也就是2017年10月...
|

|
FDA 修订关于仿制药优先申请的申报前设施通信指南
2017.11.05
美国 FDA 于 11 月 3 日发布了确保 ANDA 获得优先审评所需的《ANDA:与仿制药优先申请有关的申报前设施通信》指南草案修订版本。
作为仿制药使用者付费修正案(GDUFA II)谈判的一部分,FDA 同意将符合优先资格的仿制药的审评时间从 10 个月缩短到 8 个月,但申办人必须在 ...
|

|
GDUFA I 行动报告:FDA 和业界 5 年的行动成果
2017.11.03
在 2012 年 GDUFA 生效后,根据法案承诺的透明方案,FDA 将在网站张贴行动报告,这个公告栏网页包括一系列有关申请提交和处理的行动,公告栏每月更新一次。虽然FDA的更新步伐总是滞后 2-3 个月,我们还是在新财年过去一个月后,看到了 GDUFA I 项目最后一个月的行动报告,这也标志着 ...
|

|
FDA 发布指南解释 GDUFA II 仿制药付费相关内容
2017.10.31
10 月 27 日,美国 FDA 发布指南草案《依据 2017 仿制药使用者付费修正案评估使用者费》为企业提供了 GDUFA II 下使用者付费的评估指导。关于费用支付有一些隐藏的雷区,尤其是关于项目费和有关撤销 ANDA 请求的提醒信息,以及其对项目费层级认定的影响,包括必须支付新项目费...
|

|
IPEM 11 月课程预告 - 研发与产业化方向
2017.10.29
Integrity
授课老师:Peter Baker
上课日期:11 月 9 日上午
授课方式:中英文交传
上课地点:北大中关新园
老师简介
Peter Baker 先生现任美国 FDA 国际项目办公室(OIP)下设的中国办公室负责药品检查的代理副主任。自 2008 年以来,作为 FDA 检查官在全球...
|

|
FDA 发布对 ANDA 立卷决定的重新审议请求指南草案
2017.10.18
ANDA 申办人可以提交‘重新审议请求’,对监管决定提出异议,并且可以对美国 FDA 的某些决定(但不是全部决定)提出上诉。如果制造商仍然对结果不满意,他们可以通过正式争议解决程序。
FDA 于 10 月 12 日发布《GDUFA 下部门层面重新审议请求》指南草案,关于仿制药制造商如何对...
|

|
ANDA 申请人与 FDA 的完全回应函后会议指南草案发...
2017.10.15
美国 FDA 于 10 月 13 日发布关于 FDA和 ANDA 申请人之间 30 分钟完全回应函(CRL)后会议以帮助澄清缺陷的 行业指南草案。
该指南草案作为仿制药使用者付费修正案 II 期(GDUFA II)承诺的一部分发布,为企业提供了会议请求应包括哪些内容、如何评估会议请求、执行电话...
|

|
2018 财年 GDUFA 年费的最后支付期限:10月23日
2017.10.13
我们都知道 GDUFA II 的新收费表,其中包括:一次性收费(ANDA 申请费和 DMF 申请费)以及年度收费(API 和 FDF 场地费,ANDA 持有人费)。
ANDA 申请费的支付时间安排是在 ANDA 提交之时。而年度项目费、API 和 FDF 场地费的支付是在每财年的 10 月 1 日,有 20 天的宽...
|

|
FDA 公布 2018 财年 GDUFA 费率
2017.08.28
美国 FDA 公布了 GDUFA II 期第一年的仿制药使用者收费费率。GDUFA II 收费结构相对于 GDUFA I 有两个根本区别。首先,GDUFA I 建立在仿制药办公室(OGD)每年接收约 750 件 ANDA 的基础之上。在过去 5 年的 GDUFA I 期间收到的 ANDA 平均数量超过 1000 件。因此,FDA...
|

|
FDA 表示仿制药企业需要增加对 DMF 的沟通
2017.08.27
美国 FDA 和仿制药企业可能需要提高宣传努力,使药物主文件(DMF)持有人充分利用现有资源来讨论其申请中的问题。
行业代表在 6 月 29 日关于仿制药使用者付费(GDUFA)重新授权实施的季度会议期间向 FDA 官员抱怨关于一些 DMF 缺陷是不合适的,并且减缓了药物主文件的审查。...
|

|
FDA发布关于仿制药优先申请的申报前设施通信指南
2017.06.20
美国 FDA 于 6 月 19 日发布了确保 ANDA 优先申报更短审评时间所要求的《ANDA:与优先申报相关的申报前设施通信》指南草案。这是 GDUFA II 谈判的新规定并出现在承诺函中。GDUFA II 期的标准审评时间为10个月,但对于那些符合MaPP 5240.3(第2修订版)资格的申请,优先审评...
|

|
GDUFA II期年度项目费清理进展
2017.06.15
美国 FDA 将根据仿制药企业对 ANDA 的所有情况计算最新的仿制药使用者付费,但目前为止仍有 1900 多件 ANDA 无人认领。缺少所有权数据的申请占 FDA 已批准的所有 ANDA 的 20%,信息鸿沟将使得 10 月 1 日开始的 GDUFA II 第一年的费用估算复杂化。
GDUFA II 收费...
|

|
GDUFA II 期年度项目费估算
2017.04.14
美国 FDA 于 4 月 11 日公布了正在收集的已获批申请持有人的现有数据,这些数据可以供我们估算三个层级的项目费(program fee)金额。虽然根据我们过去所做的大概估算来看并没有太出乎意料,但预估的收费标准可能会令在中等和大企业层级的某些企业有些震惊。此外,有一张表列出了首次拥...
|

|
仿制药六个月优先审评议案受美国FDA和行业冷遇
2017.03.06
美国FDA和工业界对于最近立法中提出的仿制药6个月优先审评路径感到严重担忧,认为这一提议可能不会更快地将仿制药推向市场。虽然工业界和FDA都认同该议案的最终目标,更快地将更多仿制药竞争产品推向市场。但在3月2日美国众议院能源与商务委员会健康小组委员会举行的https//energycommerce...
|