
|
美国政府开始招标储备关键原料药
2020.08.05
美国政府正在储备可用于在未来大流行或国家紧急情况下用于生产基本药品的原料药(API),以期为美国药物供应链增加一层保护。
美国储备库之前仅限于医疗机构需要用来应对诸如飓风、大流行或炭疽爆发的药品和医疗用品。现在生物医学高级研究与发展局(BARDA)正在征求在政府战略国家储备...
|

|
美国司法部展开对制药商亚硝胺杂质虚假宣称的调查
2020.08.05
美国司法部已开始调查制药商是否没有透露畅销胃灼热药物雷尼替丁(商品为 Zantac,善胃得)中亚硝胺致癌物的信息而违反《虚假宣称法》。
赛诺菲和葛兰素史克两家公司在上周的证券文件中披露,他们在 6 月份收到了美国司法部对于可能违反《虚假宣称法》(FCA)信息的民事调查要求,...
|

|
FDA 辅料数据库更新,开始添加最大每日暴露量
2020.08.04
美国 FDA 于 7 月 29 日宣布已开始向辅料数据库(IID)中添加最大每日暴露量(MDE),预计将在 10 月之前完成。辅料行业组织对此表示支持,但希望 FDA 在完成 MDE 添加之前保留最大含量限度信息,否则可能会造成更多混乱。
MDE,也称为最大每日摄入量,是基于使用辅料的制...
|

|
国际监管机构就 COVID-19 治疗药临床试验终点达成...
2020.08.04
随着更多有关 COVID-19 潜在治疗药物的临床试验正在进行中,国际监管机构已就主要临床终点达成一致,终点的可接受性主要取决于所涉及的试验人群是中度至重度感染的住院患者还是轻度感染的门诊患者。
国际药品监管机构联盟(ICMRA)在 7 月 31 日发布的一份最新报告中解释了用于治疗 C...
|

|
【一周回顾】2020.07.27-08.02
2020.08.03
国家局公开征求药品上市后变更管理办法意见,药审中心发布 2019 年药品审评报告。识林讲座“FDA 对美国本土外制药的监管未来”视频上线。WHO 发布制药用水 GMP 指南修订草案。FDA 发布在肿瘤药研发过程中设定内毒素限度的指南以及固体口服制剂分包装指南。另 FDA 公布三篇警告信和...
|

|
FDA公布2021财年GDUFA费率,申请费上涨场地费项目费下...
2020.08.03
美国 FDA 于 7 月 31 日宣布了仿制药使用者付费项目(GDUFA)II 期第四个年头 — 2021 财年(2020 年 10 月 1 日至 2021 年 9 月 30 日)的费率。申请费(无论是 ANDA 还是 DMF 申请费)是唯一上涨的费用类别,且涨幅显著。场地费和项目费均有所下降,相比 2020 ...
|

|
【周末杂谈】孤儿药审批与“霸王监管”
2020.08.02
从法院对肌无力综合症案件的裁决,看FDA是如何“强词夺理”地保护公众利益。
FDA推崇科学和理性监管。但当一家企业刻意钻法律的漏洞,为己利而损害公众健康,FDA还可以采用“魔高一尺,道高一丈”,貌似强词夺理的办法来保护公众利益。企业不服,可将FDA告上法院。告状总是为具体事项。...
|

|
WHO 发布制药用水 GMP 指南草案第一版修订稿
2020.08.01
WHO 于 7 月 30 日发布《GMP 制药用水》指南草案第一版修订稿,修订稿在 5 月份发布的指南草案的基础上做了比较大的改动。
5 月份 WHO 因采纳使用与蒸馏等效的非蒸馏方式纯化工艺结合适当技术来生产注射用水,而修订了自 2012 年起生效的制药用水指南。指南草案发布后经过...
|

|
FDA 固体口服制剂分包装有效期指南定稿
2020.07.31
美国 FDA 于 7 月 29 日发布《固体口服制剂单位剂量分包装产品有效期》定稿指南,指南可以让企业在大多数情况下无需进行额外的稳定性研究即可将固体口服制剂从原始容器分包装到单位剂量包装中。
FDA 在指南中指出,近几十年来,各种医疗机构对于固体口服制剂分包装到单位剂量容...
|
|
FDA 发布指南解决抗肿瘤药研发早期内毒素限度问题
2020.07.31
美国 FDA 于 7 月 28 日发布《在肿瘤药物和生物制品研发过程中设定内毒素限度》的指南草案,解决了肿瘤药物开发中研究用治疗药经常与其它已获批的治疗药结合使用,或与其它研究用药物联合使用的现实问题。指南介绍了 FDA 对于新药申办人在开发与其它已获批药物组合使用或共同开发...
|

|
FDA 仿制药批准后变更补充申请降级,变更审批加速
2020.07.30
美国 FDA 正在加快审评因 COVID-19 的影响而迫切需要的简化新药申请(ANDA)批准后生产变更补充申请。在这些加快的批准后补充申请中常见的变更涉及:生产场地;生产工艺调整;批量大小(例如,放大);容器密封系统;分析方法;原料药/辅料的供应商;以及质量标准等。
在某些情况下...
|

|
法律专家回答国内企业关注的 FDA 疫情期间检查的问...
2020.07.30
美国参议院最近召开了题为“COVID-19及后续:对FDA海外制药检查程序的监督”的听证会,要求FDA对海外企业的监管更加严格。在这样的大环境下是否坚持国际化路线,应该如何坚持并应对新局势?
识林联合IPEM教育项目和美国霍金路伟(Hogan Lovells)律所,于7月25日举办了link=13px 线上...
|
|
Moderna 疫苗III期入组标准惹争议,FDA 将开展实时...
2020.07.29
美国 Moderna 公司于 7 月 27 日宣布启动针对其 COVID-19 候选疫苗的关键性 III 期试验,入组标准将排除已知新冠感染史者,引发专家疑问。当天 FDA 局长 Stephen Hahn 表示,FDA 将对 Moderna 公司的候选疫苗执行实时评价机制,实时审评从开始 III 期试验的当天开始...
|

|
美国开始生产供仿制药用的原料药和中间体
2020.07.29
一小时前,北京时间今晨 5 点 20 分,美国总统特朗普在白宫宣布了伊士曼柯达公司(Eastman Kodak Co)在美国生产 API 的 7.65 亿美元的合同,用于为美国仿制药生产 API 和中间体。
柯达公司获得的这笔合同是根据美国《国防生产法案》的首个针对 API 生产的政府贷款合同...
|
|
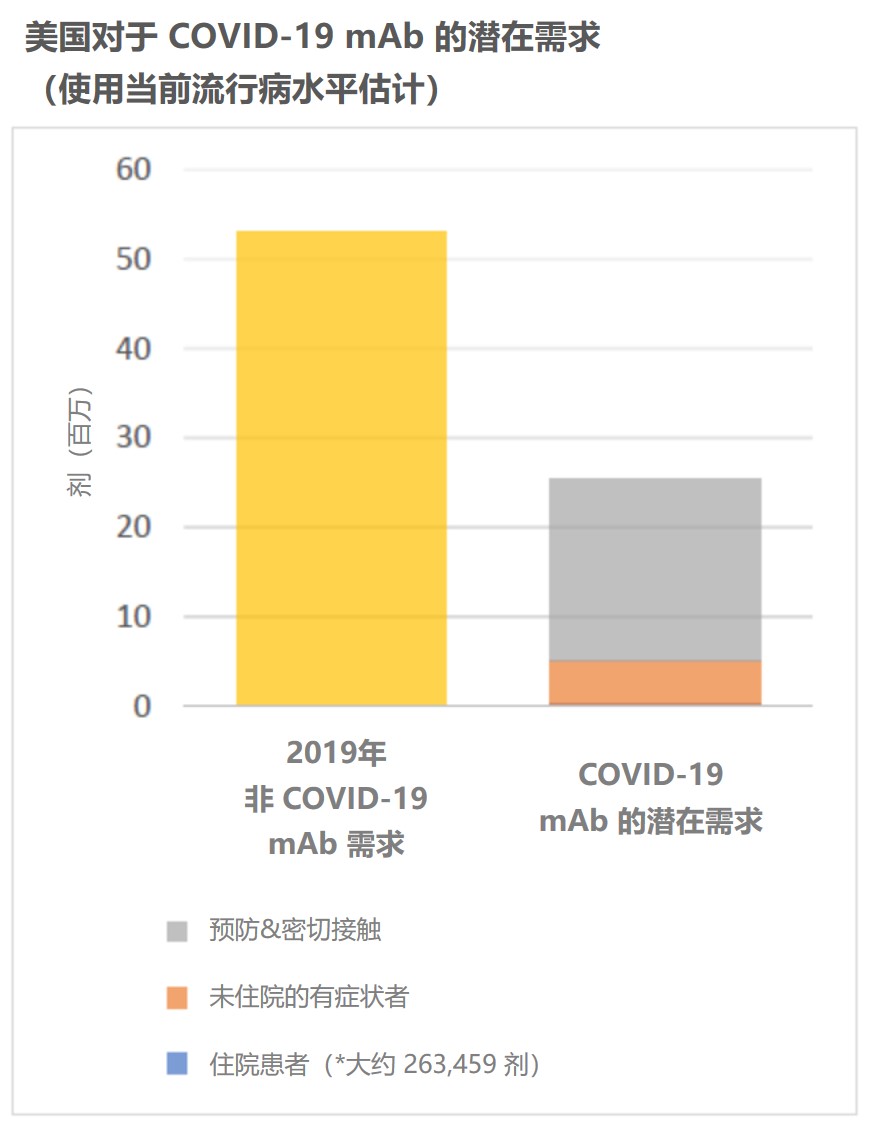
生物制药公司为共享新冠单克隆抗体制造信息扫清监管障...
2020.07.28
美国司法部同意几家大型生物制药公司的申请,对于共享与治疗 COVID-19 的单克隆抗体(mAb)药物相关的某些详细制造信息,不实施任何反托拉斯限制。
正在开发中的用于治疗 COVID-19 的单克隆抗体包括可以直接靶向冠状病毒的中和抗体,以及可以解决急性呼吸窘迫综合症的抗体。中和...
|
|
FDA 发论文为亚硝胺检测方法辩护,USP 推出检测亚硝...
2020.07.28
美国 FDA 认为其对二甲双胍中 N-亚硝基二甲胺(NDMA)的检测结果比私营实验室 Valisure 的结果更准确。7 月份发表在美国药物科学家协会(AAPS)上的一篇论文为 FDA 的检测方法做了辩护。FDA 表示,私营实验室的方法“不适用于对二甲双胍药品中的 NDMA 进行定量分析,原因是存...
|

|
【一周回顾】2020.07.20-07.26
2020.07.27
识林推出“中国、欧盟附条件批准程序对比”以及带注释版《药品生产监督管理办法》。药审中心发布药物临床数据递交以及相关指南。卫健委发布抗菌药临床应用及儿童抗菌药应用指南。WHO 发布扎那米韦及吸入粉雾列入国际药典的提案草案。EMA 发布制药用水质量定稿指南。FDA 两大审评收费...
|

|
FDA 处方药收费新一轮谈判可以期待些什么?
2020.07.27
细胞与基因疗法成为关注重点,真实世界证据仍将加码
继仿制药使用者付费(GUDFA III)重新授权首次公开会议之后【GDUFA III 谈判拉开帷幕,业界提出多条改进建议 2020/07/23】,FDA 处方药使用者付费(PDUFA) VII 重新授权首次公开会议也于 7 月 23 日召开,会上 FDA、...
|

|
【周末杂谈】从立法看科学和理性监管
2020.07.26
仿制药标签修订法案中,多数条款是约束FDA而不是企业行为的。
非资源性日用消费品市场,市场经济应是最有效的。药品市场是例外,原因之一是有药监局的存在。对药监局而言,保护和促进公众健康是使命,干预市场是手段,依法定规、行规及释规是功能。因此,要想科学理性监管,首先药品法...
|

|
真实世界证据对随机对照试验的复制能力与支持监管决策...
2020.07.25
随机对照试验(RCT)一般被认为是评价药物安全性和有效性的金标准,并为药物临床研究普遍采用。然而,传统RCT所需的长时间和高成本以及日常诊疗电子健康数据的激增,使人们越来越关注真实世界数据(RWD)能否开发为支持监管决策的真实世界证据(RWE)。RWE已对批准后药物安全性监管决策做...
|