
|
【周末杂谈】OAI、透明公开监管与产业发展
2020.01.12
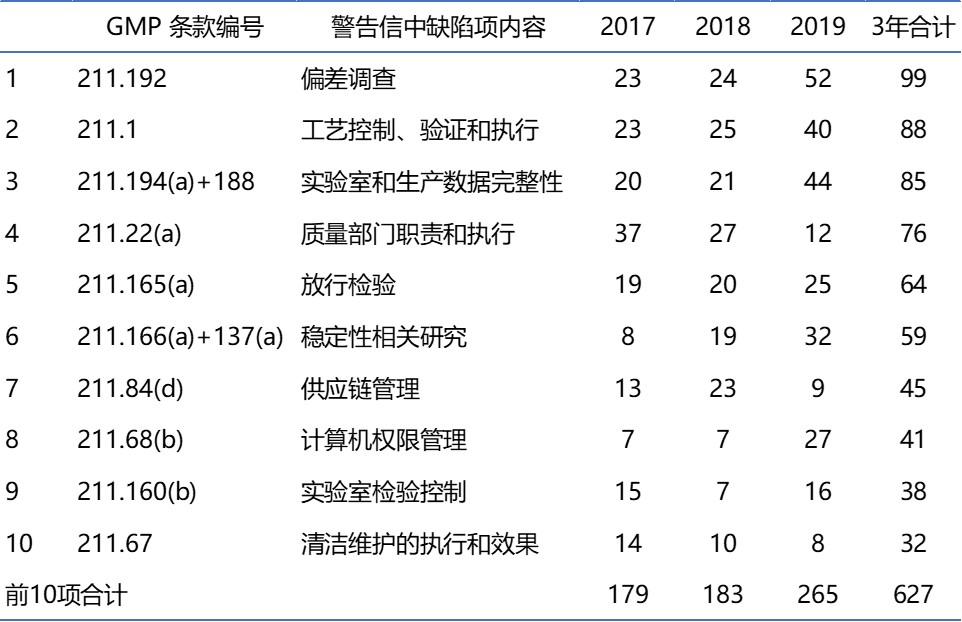
上月11日,在美国食品药品法研究所在华盛顿举行的一次会议上,FDA药品审评和研究中心合规办公室(Office of Compliance,OC)主任D. Ashley高兴地报告,2019财年(9月30日截至),在GMP检查后90天(本文引用的都是自然天,不是工作日)内,OC完成了86%的检查结果分类,比2018财年增加...
|
|
【周末杂谈】从FDA警告信看GMP“软件”部分的重要性
2020.01.05
上周的周末杂谈“判断是否低于成本竞标,不容易”,谈到与药品生产相关的“硬件”成本,包括:设施、设备、物料、能耗、人工及管理费用方便计算;“软件”成本,例如:处方工艺研发、GMP管理和合规运行的费用难于计算。今天的杂谈想说这个“软件”部分,尽管成本难以计算,其重要性不可低...
|

|
两家美国公司因 GMP 违规收到 FDA 警告信
2019.12.12
美国 FDA 于 12 月 10 日因 GMP 违规向两家美国制药商发出警告信,这两家公司分别为位于新泽西州 Buena 市的 Teligent 药业和位于德克萨斯州 Mineral Wells 市的 OHM 药业公司。警告信原文及翻译请登录识林阅览。
Teligent Pharma
FDA 于今年 4 月到 5 月期间对 T...
|
|
美国 FDA 向印度制药与器械企业发布的警告信分析
2019.11.21
在过去 14 年内,FDA 向印度制药和器械企业发出的警告信数量逐渐增多。在警告信列出的所有违规行为中,85.87% 与 CGMP 不合规有关。此外,在这些警告信中有 80.72% 在之后没有关闭函。
这一回顾性研究于 11 月 5 日发布于 DIA 《治疗创新与监管科学杂志》上,分析回顾了 20...
|

|
FDA 最新警告信再次显示对缬沙坦供应链前端的关注
2019.11.14
美国 FDA 于 11 月 12 日公布的给 Mylan 公司的警告信再次表明,由于去年发现在某些降血压药的活性药物成分中含有致癌的亚硝胺杂质,FDA 检查员正在将他们的注意力进一步转移至药品供应链上,之前对原料药供应商的关注日益增加,现在焦点已经转向原料药供应商的供应商。
在 Myl...
|
|
FDA 从未检查过的生产场地中四分之一 GMP 不合规
2019.11.08
我们在昨天的资讯中介绍了从 2015 财年到 2019 财年,FDA 发出的与生产质量相关的警告信数量激增,从 2015 财年的 19封到 2019 财年的98 封,昨日我们介绍了这些警告信的去向以及警告信周转时间缩短【FDA 警告信数量增加时间缩短,原料药商应注意三大趋势】。今天我们来看看导...
|

|
FDA 警告信数量增加时间缩短,原料药商应注意三大趋...
2019.11.07
美国 FDA 药品审评与研究中心(CDER)合规办公室主任 Donald Ashley 于 11 月 5 日在普享药协会(AAM)会议上对原料药(API)商提出了几项主要关切,指出了与供应链信息混淆、越来越多的数据可靠性问题以及导致召回的杂质问题相关的三大趋势。这些趋势基本与之前的报告类似,详见【FD...
|

|
FDA 对于如何更好开展 OOS 调查的建议
2019.10.16
美国 FDA 持续在 483 和警告信中报告不良超标(OOS)调查,这是 FDA 目前急于解决的问题。FDA 药品审评与研究中心(CDER)合规办公室(OC)高级政策顾问 Brooke Higgins 在 9 月 17 日的 PDA/FDA 联席监管会议上表示,尽管 13 年前(2006 年)就已经发布处理 OOS 调查...
|

|
FDA 再发警告信敦促再包装商披露原料药供应商
2019.10.02
美国 FDA 最近向重庆伊诺生化制品公司发出的警告信是 FDA 为保护美国患者免受药品供应链不透明带来的某些质量风险而采取的一系列行动中的最新动作。FDA 药品审评与研究中心(CDER)生产质量办公室(OMQ)主任 Francis Godwin 表示,这项工作正在使供应链更加透明,但仍需继续保持...
|

|
FDA 总结 2019 财年警告信四大趋势
2019.09.24
美国 FDA 生产质量办公室副主任 Rick Friedman 于 9 月 16 日在华盛顿举行的 PDA/FDA 联席监管会议上,对 2019 财年最新 GMP 违规导致的警告信发布情况做了通报,并通过最近一些警告信来举例说明了检查员发现的一些缺陷项。
本财年到目前为止生产质量办公室已发布 89 封...
|

|
从警告信看 FDA 对 OTC 生产商的四个关注重点
2019.09.05
美国 FDA 最近向非处方药(OTC)和保健产品生产商发出的一连串警告信显示了与 GMP 和质量管理监管期望相关的相似缺陷。
这些警告信中反复出现的许多基本问题表明了质量管理体系(QMS)的潜在不足之处。其中包括由于管理不善以及缺乏合适的经验证的检测所导致的微生物污染,生产操作...
|

|
FDA 公告对一家药商伪造文件的惩处
2019.08.22
美国 FDA 于 8 月 20 日在其新闻公告中表示向一家中国非处方药(OTC)制药商发出了一封警告信,内容涉及包括数据可靠性在内的 CGMP 违规行为。这是 FDA 不太常见地通过新闻公告和邮件订阅的形式公布其向某家公司发出警告信,宣传力度之大或许与公司所生产的产品性质有关,FDA ...
|

|
FDA 向国外发出的警告信四分之三涉数据可靠性
2019.08.13
昨天的资讯介绍了企业如何换个角度从监管视角审查自身问题,在监管检查之前发现隐藏的数据可靠性缺陷。今天我们从一些警告信观察项数据以及资深专业人士的建议来继续看看如何及早、高效的发现数据可靠性问题。
前 FDA 检查员、Parexel 咨询公司副总裁 Ron Tetzlaff 于 2019 年...
|

|
当 CMO 收到警告信时,你该怎么办?
2019.07.24
当你作为一家制药商,寻找到一个合适 CMO,并且完成了前期的调查、审计、技术转移、变更申报等一系列准备工作,就要开始生产或者已经开始生产了,此时你的合同商收到了警告信,你会如何反应,又该怎么办?
背景
你作为药品上市申请的持有人,刚刚对你所拥有的商业销售药品完成了向...
|

|
Akorn 因根源调查不力再收 FDA 警告信
2019.07.12
美国 FDA 于 6 月 13 日发给 Akorn 公司的警告信中指证公司对杂质和瓶子缺陷问题执行了错误的根源调查,无菌操作不良以及对计算机设备控制不足。Akorn 的警告信显示了一种趋势,即,FDA 在企业超标(OOS)调查中发现越来越多的 GMP 违规行为,这一问题正有逐渐取代数据可靠性成为...
|

|
数据可靠性危机导致 Apotex 撤销 31 件已获批 AND...
2019.07.11
加拿大制药商 Apotex 公司因其在印度班加罗尔的两家工厂持续存在数据可靠性和质量部门失效问题,而要求撤销美国的 31 个获批仿制药申请。美国 FDA 于 7 月 10 日在联邦公报上发布撤销通告,并列出具体撤销名单。
Apotex 公司撤销仿制药申请的决定是近年来数据可靠性危机所...
|

|
FDA 连发警告信加强对原料药再包装商的监管
2019.07.05
从最近分别签发给三家原料药再包装商的警告信中,美国 FDA 对供应链透明度的担忧可见一斑。三家再包装商都未能向其客户披露原料药原始生产商的名称,这种做法曾是原料药行业的常见操作,但 FDA 现在希望叫停这种做法。
这三家再包装商均位于美国境内,分别是科罗拉多州 Englewood ...
|

|
设备没清洗?工人欢度假期去了
2019.06.01
警告信是掌握美国FDA的CGMP合规要求和趋势的重要学习资料,不仅包含制药企业不该触碰的合规“红线”,还警示企业遇到问题不该采用的错误解决思路。但今天我们选出的这封警告信却有着搏君一笑的作用,其中的缺陷项并不独特,但是企业的解释却令人称奇。
这是一封美国 FDA 于 5 月 2...
|

|
FDA 因 GMP 违规对顺势治疗产品公司发布警告信
2019.04.04
由于严重违反 GMP,美国 FDA 于 4 月 1 日向四家顺势治疗(homeopathic)药品制造商发布警告信【Tec Laboratories Inc、 Red Mountain Inc、 King Bio Inc.、 B. Jain Pharmaceuticals Private Limited】。警告信包括一家反复违法的公司,FDA 之前已经警告过其重大 CG...
|

|
FDA 宣布启动供应链安全试点计划并向大型供货商开刀
2019.02.15
美国 FDA 于 2 月 7 日宣布接受来自制药行业及其供应链合作伙伴的申请参与供应链安全试点计划,以测试用于在整个供应链中追溯跟踪处方药的产品标识符、条形码和互操作系统的使用。
《药品供应链安全法案》(DSCSA)于 2013 年 11 月 27 日签署成为法律,概述了构建可以识别...
|