
|
【周末杂谈】触家规就是犯国法吗?
2020.08.16
了解美国是如何将药品法与GMP规章和企业内部操作绑在一起的
没按SOP做,就是违法吗?
SOP是企业的家规,与《药品法》有何关系?
与罚款更多的《虚假宣称法》又有何关系?
简单的答案是,关系直接且密切。
先来看看美国历史上两件最大的因GMP违规,而受到法庭处罚的案例。
第一个...
|
|
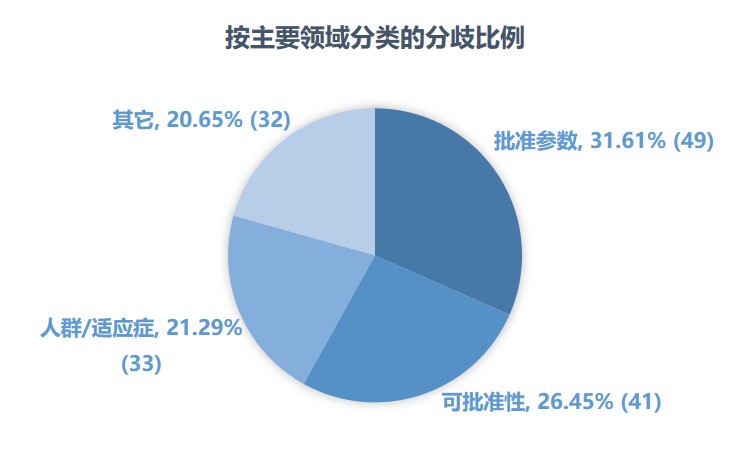
FDA 新药批准近四分之一存在内部审评意见分歧
2020.08.15
自美国 FDA 于去年夏天宣布以综合审评文件取代基于学科的审评文件包以来,研究人员和利益相关者们就一直持反对意见,担心能看到的公开信息会随之减少,一些有价值的信息将无法轻易获得,其中 FDA 内部审评意见的分歧就是最有价值的信息之一。研究人员最近发表的一项分析就反映了这方面...
|

|
欧盟发布对孤儿药和儿科用药法规的全面评估报告
2020.08.14
欧盟委员会于 8 月 11 日发布了其对于罕见疾病和儿科用药立法的评估报告,这是欧盟《孤儿药法规》和《儿科用药法规》分别于 2000 年和 2006 年颁布以来的首次全面评估。评估报告显示,尽管这两项法规促进了新药的开发和供应,但并未成功将投资引导至最需要的领域。报告正文长达 10...
|

|
FDA 供应链安全试点:错误率更低更高效的射频识别标...
2020.08.14
美国 FDA 最近的一项供应链安全试点显示,在药品供应链中,除条形码外,还需要使用射频识别(RFID)标签,可以减少识别错误,提供更有效的方式来确保供应链的完整性并防止药品造假。
Sandoz 的母公司诺华美洲区域序列化负责人 David Mason 在 7 月 31 日的《药品供应链安全法案》...
|
|
FDA 发布针对治疗性蛋白质的药物相互作用指南草案
2020.08.13
美国 FDA 于 8 月 7 日发布新指南草案《治疗性蛋白质的药物与药物相互作用评估》,通过提供一种系统的、基于风险的方法,帮助研究用新药申请(IND)的申办人、生物制品许可申请(BLA)的申请人确定对于治疗性蛋白质进行药物-药物相互作用(DDI)研究的需求。
指南草案由药品审评与...
|

|
美国国家研究所牵头研究 COVID-19 疫苗制造问题
2020.08.13
美国国家生物制药制造创新研究所(NIIMBL)于 7 月 28 日举办网络研讨会,会上目前新冠(COVID-19)疫苗研发的几大主要参与者探讨了疫苗制造技术问题以及 NIIMBL 可以帮助解决的方面。
为保护人们免受 COVID-19 感染,疫苗制造商将重点放在尽快生产疫苗上,但是针对速度的优...
|

|
FDA 新药与仿制药上市状态通知要求指南定稿
2020.08.12
美国 FDA 于 8 月 10 日发布有关新药和仿制药的上市状态通知定稿指南 — 《根据 FDCA 506I 的上市状态通知;内容与格式》,明确了其对于申请持有人在产品撤市或产品获批后无法销售时提交上市状态通知的监管期望。
根据《2017 FDA 重授权法案》(FDARA),要求制药商在药品...
|
|
FDA 局长和主任联合发文增强公众对新冠疫苗的信心
2020.08.12
为打消公众对于新冠(COVID-19)疫苗的担忧,增强疫苗的信心,美国 FDA 局长、副局长和生物制品中心主任联合撰文,向公众解释和保证对 COVID-19 疫苗的严格监管。
FDA 局长 Stephen Hahn 医学博士、生物制品审评与研究中心(CBER)主任 Peter Marks 医学博士和 FDA 副局长 Ana...
|

|
制药商对于从美国工厂购买基本药物的行政令反应如何?
2020.08.11
美国总统特朗普于 8 月 6 日签署“购买美国产品(Buy American)”的行政令,指示联邦政府更多地依赖美国本土制药工厂采购基本药物。【美国总统行政令要求仅能从美国工厂购买基本药物 2020/08/07】虽然行政令的许多细节尚不清楚,但仍受到全球制药商的批评。
COVID-19 大流行...
|

|
瑞德西韦:向 FDA 提交新药申请,与辉瑞合作扩大生...
2020.08.11
吉利德(Gilead)公司的瑞德西韦(remdesivir)是至今为止唯一一个获得监管部门批准用于治疗 COVID-19 患者的药品。瑞德西韦已在欧盟、日本、澳大利亚和英国获得有效条件上市许可,在美国获得紧急使用授权(EUA)。吉利德于https//www.gilead.com/news-and-press/press-room/press-re...
|

|
【一周回顾】2020.08.03-08.09
2020.08.10
上周中美关系仍是制药界关注焦点之一,美国总统颁布行政令要求联邦政府从美国工厂购买基本药物,并且开始招标储备关键原料药。识林推出基因毒性杂质专题,以及有关使用 QSAR 软件预测化合物的致突变性的案例解析。CDE 发布多篇技术指南,包括化药注射剂灭菌和无菌工艺研究及验证、群...
|

|
欧盟发布亚硝胺杂质问答指南,给出杂质评估、检测和缓...
2020.08.10
欧洲药品管理局(EMA)于 8 月 6 日发布更新后的问答指南文件为上市许可持有人(MAH)提供了有关亚硝胺杂质处理的建议。指南给含化学合成 API 的 MAH 更多时间用来评估产品中是否存在有潜在致癌性的亚硝胺杂质,还为含生物药 API 的制剂的 MAH 执行类似的评估设定了新的截止日期...
|

|
【质量对话】糊里糊涂地谈质量?
2020.08.09
药品质量是常见的话题和用词,但几乎找不到其明确的定义。
编辑:《质量对话》这个专栏,已经做了几次了,但好像还从没有明确过我们所说的“质量”是什么意思,具体讲就是在这个专栏里,我们是如何理解“药品质量”?
刺槐:我查了《药品管理法》、《药品注册管理办法》和《药品生产...
|
|
FDA 发布 2019 财年上市后要求和承诺年报
2020.08.08
美国 FDA 在其近日发布的关于制药商执行上市后要求(postmarketing requirement, PMR)和上市后承诺(postmarketing commitments, PMC)的绩效年报
中表示,大多数上市后研究正在按期进行。
上市后要求是申请人被要求执行的批准后研究或临床试验,上市后承诺是申请人书面同意...
|

|
FDA 批准首款脊髓性肌萎缩症(SMA)口服治疗药
2020.08.08
美国 FDA 于 8 月 7 日宣布批准了首款治疗脊髓性肌萎缩症(SMA)的口服治疗药 — Evrysdi(risdiplam),为目前依赖昂贵注射治疗产品的患者提供了新选择。SMA 是一种罕见且通常致命的遗传疾病,影响肌肉力量和身体运动,可导致瘫痪、呼吸困难和死亡,是婴儿死亡的主要遗传原因。
...
|

|
FDA 质量基准研究向全球召集参与企业
2020.08.07
企业匿名参与,研究结束后可获得一份只有自己能够看到的定制报告
美国FDA一直都在寻找如何能继续推进和落实质量量度计划,而且试图从业界和学术界的试点和研究中获得更多知识,以期找到可行之路。
奖励质量(或者可以说“优质优价”),是 FDA 一直想做的事,2013 年FDA 就提出单靠...
|

|
美国总统行政令要求仅能从美国工厂购买基本药物
2020.08.07
美国总统特朗普于两个小时前宣布https//www.whitehouse.gov/presidential-actions/executive-order-ensuring-essential-medicines-medical-countermeasures-critical-inputs-made-united-states/ 签署了一项行政令,指示联邦政府仅能从美国工厂购买基本药品和其他医疗...
|

|
FDA 大力宣传先进制造以解决疫情凸显的制造和供应链...
2020.08.06
美国 FDA 局长 Stephan Hahn 以及医疗和科学事务副局长 Anand Shah 在 8 月 3 日 FDA 博客文章中表示,可以采用先进制造技术来解决美国在 COVID-19 大流行期间遇到的一些制造和供应链问题。文章提到当前对制药业回迁美国的广泛关注,强调仅重视问题并不足以将供应链回迁...
|

|
全球药品供应链大势:从对乙酰氨基酚说起
2020.08.06
美国《华尔街日报》今日刊发的一篇文章从一种最简单的非处方止痛药对乙酰氨基酚入手,试图描绘当前全球药品供应链对中国的依赖程度,以及中国原料药生产的优势和原料药回迁美国的困难。
对乙酰氨基酚只是目前在中国生产的大量原料药(API)之一,大多数 API 是美国制药商发现无利可图...
|

|
美国政府开始招标储备关键原料药
2020.08.05
美国政府正在储备可用于在未来大流行或国家紧急情况下用于生产基本药品的原料药(API),以期为美国药物供应链增加一层保护。
美国储备库之前仅限于医疗机构需要用来应对诸如飓风、大流行或炭疽爆发的药品和医疗用品。现在生物医学高级研究与发展局(BARDA)正在征求在政府战略国家储备...
|