
|
英国 MHRA 2019 年 GMP 检查缺陷趋势分析
2020.10.20
英国药品与医疗保健产品监管机构(MHRA)于 2020 年 10 月 15 日发布了其 2019 年的 GMP 检查缺陷。与去年一样,2019 年 GMP 检查缺陷数据同样采用了电子表格的形式,共5293 行数据。有兴趣者可以根据需要自行解析和呈现数据。【英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览...
|

|
【一周回顾】2020.10.12-10.18
2020.10.19
生物安全法颁布,国家局公开征求疫苗责任强制保险管理办法意见,药审中心发布境外已上市境内未上市药品临床技术要求。FDA 重新发布中国产未经 NIOSH 批准的过滤式面罩呼吸器的紧急使用授权,批准首个埃博拉病毒治疗药。欧盟要求含二甲双胍类药物的上市许可持有人检测产品中亚硝胺的存...
|
|
FDA 疫苗负责人强调新冠疫苗紧急使用授权后安慰剂对...
2020.10.19
美国 FDA 官员表示,即使在紧急使用授权(EUA)之后,新冠病毒疫苗的试验仍需维持安慰剂对照,以许可多款候选疫苗。
10 月 16 日发表在《新英格兰医学杂志》上的一篇观点文章1中,FDA 生物制品审评与研究中心(CBER)疫苗研究与审评办公室的副主任 Philip Krause和主任 Marion Gr...
|
|
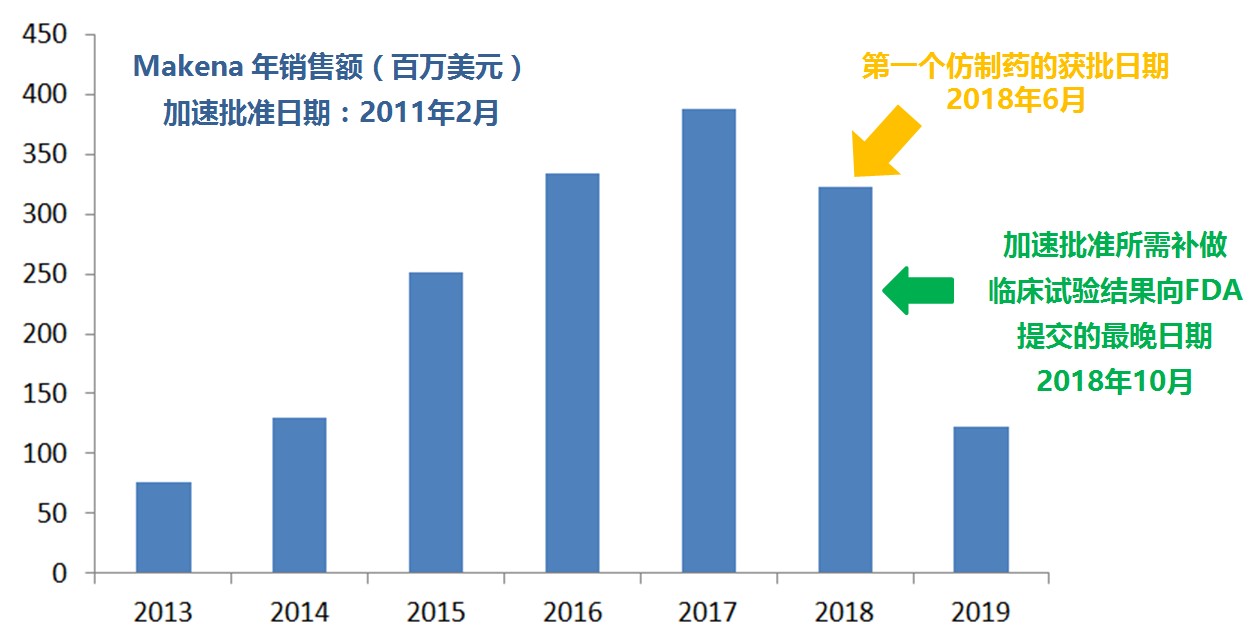
【周末杂谈】加速批准与缓慢撤销
2020.10.18
企业钻FDA加速批准漏洞的例子
加速批准是有条件的批准,不是彻底批准(full approval)。条件之一是,企业要按与FDA达成的协议,在协定的时间内,完成协定的临床确认性试验。条件之二是:若达到预期的临床获益与风险比,FDA会将加速批准提升为彻底批准,否则将“加速”撤销加速批准。这是...
|

|
ICH 将大幅修订 E19 安全性数据收集指南
2020.10.17
ICH 正在对其 E19 安全性数据收集的优化指南草案进行重大更改,该草案建议在药物安全性得到充分表征时,可以在某些上市前后期或上市后研究中选择性收集安全性数据。
默沙东的欧洲 QPPV Guy Demol 在 10 月 6 日至 8 日举行的 DIA 药物警戒受权人(QPPV)全球论坛上表示...
|

|
FDA 宣布两项质量管理成熟度试点计划
2020.10.16
美国 FDA 药品审评与研究中心(CDER)今日宣布了两项新的试点计划,以从对制药商质量管理体系的第三方评价中获得洞察,从而为 FDA 表征质量管理成熟度(QMM)评级系统的未来发展提供参考。
成品制剂质量管理成熟度试点计划(QMM FDF 试点计划)适用于处方药和非处方药(OTC)药品...
|
|
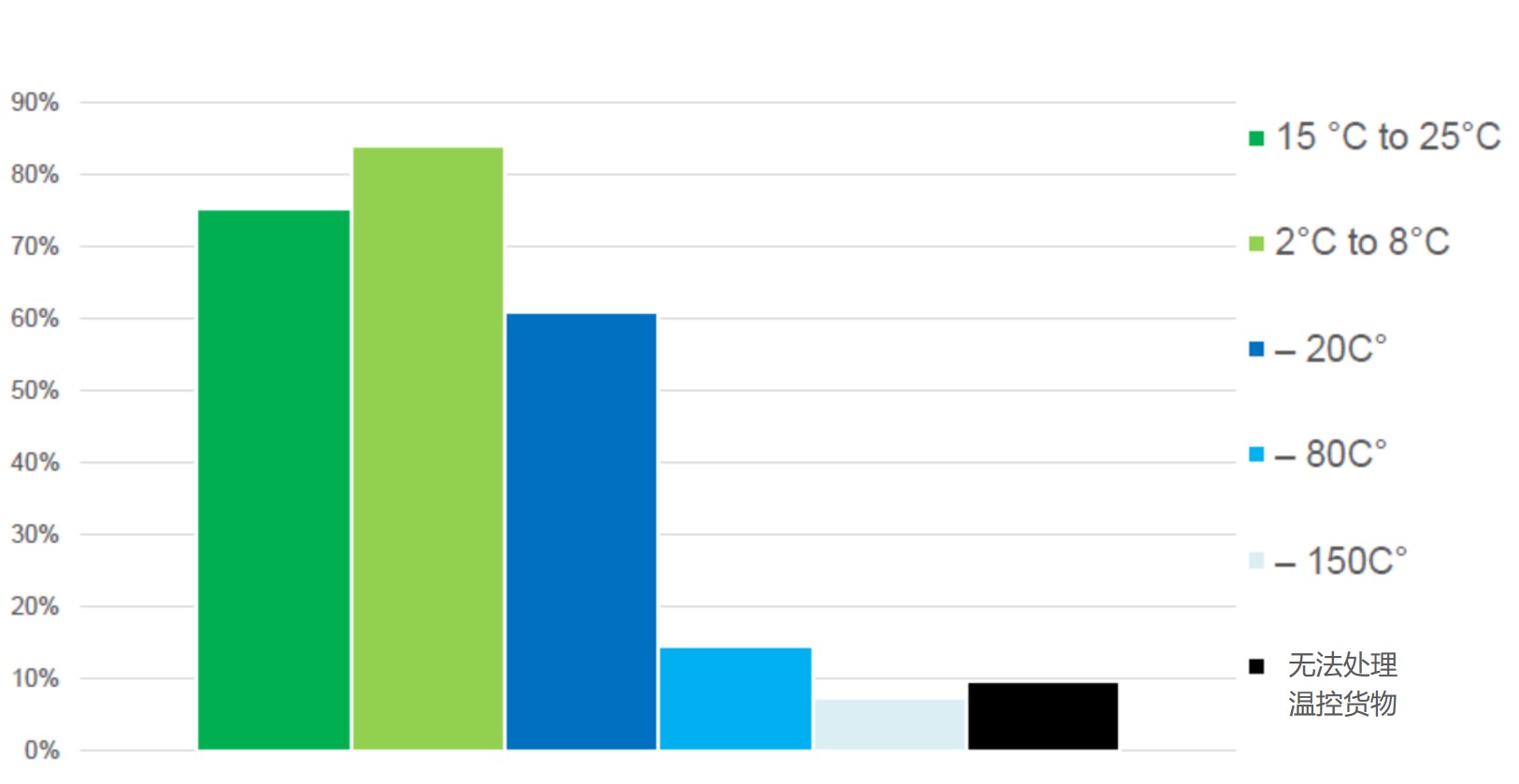
绝大多数航空货运公司未准备好运输新冠疫苗
2020.10.16
全球大部分地区的制药公司都在奋力研发新冠疫苗和治疗药以缓解疫情,但一项新的调查显示,目前只有 28% 的航空货运公司做好了在全球范围内运输新冠疫苗的准备工作。同时有 12% 的公司表示他们认为“准备非常不足”,只有 54% 的航空货运提供商拥有一些处理疫苗的必要设备。
这...
|

|
礼来计划生产新冠治疗性抗体的工厂爆出删除数据和造假...
2020.10.15
美国 FDA 检查员在礼来公司的制药工厂发现了严重的质量控制问题,该工厂正在准备生产一种颇具希望的新冠抗体治疗药物。
礼来的实验性药物称为 LY-CoV555,是一种单克隆抗体,与特朗普患病期间使用的 Regeneron(再生元)的药物类似,其作用是识别并锁定外来入侵者,从而阻止健康细...
|

|
AI 将取代药物警戒人员?不!
2020.10.15
两天前我们在【英国 MHRA 将在药物警戒领域发布首份 AI 指南】一文中介绍了英国监管机构对于在药物警戒中使用 AI 的立场和关注点。今天我们来看看有关随着企业越来越多地使用人工智能(AI)工具,药物安全性专业人员必须掌握哪些新技能。
在 10 月 6 日至 8 日举行的药物信息...
|

|
FDA 与 MHRA 介绍疫情下现场 GMP 检查操作新常态
2020.10.14
美国 FDA 在最近召开的 PDA/FDA 会议上建议,在疫情期间进行现场检查的制药企业应通过视频而非现场会议与检查员交流,将文件室移到室外,避免使用纸张等。英国 MHRA 也有类似的建议。
FDA:室外,电子文件,现场远程会议
FDA 监管事务办公室消费者安全官 Rachel Harringto...
|

|
过去十年批准的新药仅不到三分之一具有高治疗价值
2020.10.14
最近一项发表在《英国医学杂志》(BMJ)上的研究1发现,2007 年至 2017 年十年间,美国 FDA 和欧洲药品管理局(EMA)批准的新药中只有不到三分之一具有高治疗价值。但是,分析发现,通过加快审评计划(尤其是 EMA 的加快审评计划)批准的药物可能有更高的比例具有高治疗价值。
...
|
|
英国 MHRA 将发布首份药物警戒 AI 指南
2020.10.13
英国药品与医疗保健产品监管机构(MHRA)正在开发一个协调框架,以支持使用或计划采用 AI 技术的上市许可持有人(MAH),帮助他们在 MHRA 的检查过程中处理相关验证问题,涉及该主题的首份指南将侧重于在 AI 方面取得了重大进展的药物警戒领域。
MHRA 警戒情报和研究小组组长 Phil T...
|

|
欧盟监管系统需要更多新技术与 AI 专家
2020.10.13
欧洲药品监管网络需要快速建立其在数据分析和数字转化方面的能力,但是面对来自制药行业以及科技行业巨头的激烈竞争,要招到必要的员工很困难。
丹麦药品管理局局长、欧盟药品机构(HMA)管理团队负责人 Senderovitz 在 10 月 5 日举行的法规事务专家组织(TOPRA)年度会议上发表...
|

|
【一周回顾】2020.10.04-10.11
2020.10.12
国家局发布药品委托生产质量协议指南。美国 FDA 发布新冠疫苗紧急使用授权指南,建议撤回对早产预防药物 Makena(己酸羟孕酮)的批准。欧盟发布关于数据监查委员会的问答。英国 MHRA 发布生物类似药许可指南。
上周热点资讯:
FDA 发布新冠疫苗紧急使用授权指南,提出详细信息和...
|

|
欧盟药物战略:平衡创新激励与竞争
2020.10.12
欧盟委员会正在努力让利益相关者对其拟议欧盟药物战略反馈意见,并希望在今年年底之前发布一份信息通报,概述该战略将采取的主要立法和其它行动。
战略涉及整个欧洲药物领域,包括如何在创新激励与保持竞争的需求之间取得平衡,欧洲对原料药(API)越来越依赖第三国,供应链安全性,药...
|

|
【周末杂谈】一堂独特的创新药课程
2020.10.11
创新药研发案例分析 — 吉利德的故事,科学和商务
上周此专栏称仿制药是无名英雄,有朋友说有些偏袒仿制药了,建议这周说些创新药的事。周末杂谈,顾名思义,就是想起什么就说什么。庶民杂谈,恐怕没人在乎对错,即使说对,也纯属偶然。若是其中只言片语能对个别读者有一点参考作用,...
|
|
FDA 支持建立复杂仿制药研究中心,促进协作研究和培...
2020.10.10
美国 FDA 希望一个由学术机构运营的独立团队可以促进行业对复杂仿制药研究的参与。
美国马里兰大学和密歇根大学将获得为期五年的 500 万美元资助,用于建立复杂仿制药研究中心(Center for Research on Complex Generics,CRCG),旨在“促进创新对话,传播当前对复杂产品和实...
|
|
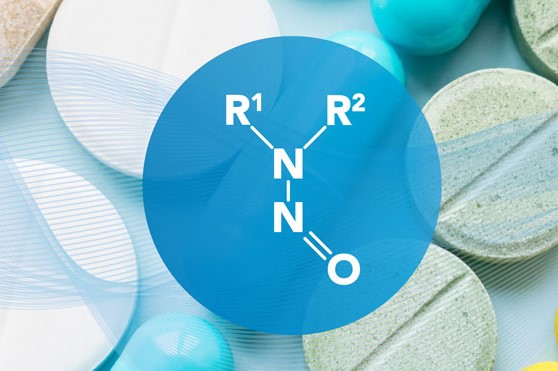
FDA 专家就如何评估和避免亚硝胺污染提供建议
2020.10.09
美国 FDA 最近建议制药商通过充分控制生产工艺和供应链并了解可能会随时间推移而影响药物稳定性的因素来避免亚硝胺污染。
在 10 月 2 日的 FDA 有关可能引入亚硝胺杂质的条件以及如何进行风险评估小型企业援助(SBIA)网络研讨会上表示,制药商可以将上述这些领域作为进行风险...
|
|
FDA 发布新冠疫苗紧急使用授权指南,提出详细信息和...
2020.10.08
美国 FDA 于 10 月 6 日发布了《预防 COVID-19 疫苗的紧急使用授权》指南,解释了紧急使用授权(EUA)的法定标准,并提供了有关 FDA 希望支持 EUA 申请的法规,化学、生产和控制(CMC)以及安全性和有效性信息的建议。
这份 EUA 指南的发布可谓是历尽波折,上个月 FDA 局长 St...
|

|
2020 美国制药业公众形象倒数第二,医疗卫生业形象大...
2020.10.08
美国盖洛普(Gallup)一年一度对行业形象的民意调查已经发布,2020 年制药业的调查的 25 个行业中排名倒数第二,比 2019 年上升了一个名次,把“最差殊荣”再次让给了联邦政府。
2020 美国公众对美国各产业的看法
今年的排名反映了六个行业的评分发生了重大变化,其中三个...
|